
【题目】石油资源紧张曾是制约中国发展轿车事业,尤其是制约轿车进入家庭的重要因素。据报道,中国宣布将推广“车用乙醇汽油”。
(1)乙醇燃烧时如果氧气不足,可能还有CO生成.用下图装置正确验证乙醇燃烧产物有CO、![]() 、
、![]() ,应将乙醇燃烧产物依次通过,按气流从左至右顺序填装置编号______。
,应将乙醇燃烧产物依次通过,按气流从左至右顺序填装置编号______。
编号 | ① | ② | ③ | ④ |
装置 |
|
|
|
|
(2)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是______;B瓶溶液的作用是______。
(3)装置①中所盛的是______溶液,证明燃烧产物中含有CO的实验现象是:______。
(4)装置④中所盛的固体药品是______,它可以验证的产物是______。
【答案】④②③① 验证![]() 存在 除去混合气体中的
存在 除去混合气体中的![]() 澄清石灰水 C中无明显现象,①中溶液变浑浊 无水硫酸铜
澄清石灰水 C中无明显现象,①中溶液变浑浊 无水硫酸铜 ![]()
【解析】
(1)④是无水硫酸铜,①是澄清石灰水,乙醇燃烧产物中有CO、CO2和H2O,检验CO可用热的氧化铜,根据固体颜色的变化;检验二氧化碳可以用澄清石灰水,看是否变浑浊;检验水用无水硫酸铜,看是否变蓝色;三者都有时,应先检验水蒸气的存在,因为在验证二氧化碳、一氧化碳的存在时都需通过溶液,可带出水蒸气;再检验二氧化碳,最后除去二氧化碳后,再根据固体颜色变化和产物检验一氧化碳;
(2)根据二氧化碳可以用澄清石灰水变浑浊,氢氧化钠与二氧化碳反应,能吸收二氧化碳,装置②中A瓶的石灰水变浑浊是检验二氧化碳,B中氢氧化钠是吸收二氧化碳,C中瓶的石灰水是检验二氧化碳是否被除尽;
(3)③和①配合来检验一氧化碳,③是反应装置,①用来检验反应产物;
(4)先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳的存在时需通过溶液,可带出水蒸气。
(1)根据上述分析可知,装置连接顺序为④②③①,
故答案为:④②③①;
(2)根据二氧化碳可以用澄清石灰水变浑浊,氢氧化钠与二氧化碳反应,能吸收二氧化碳,装置②中A瓶的石灰水变浑浊是检验二氧化碳,B中氢氧化钠是吸收二氧化碳,C中瓶的石灰水是检验二氧化碳是否被除尽,
故答案为:验证CO2存在;除去混合气体中的CO2;
(3)③和①配合来检验一氧化碳,③根据颜色变化判断可能含有一氧化碳,并将一氧化碳氧化成二氧化碳,再用①来进一步确认生成的是二氧化碳,所以③的作用是将CO氧化成CO2;①中所盛的是澄清石灰水,作用为检验由CO与CuO反应所生成的CO2,从而确定有CO气体,C中无明显现象,①中溶液变浑浊,
故答案为:澄清石灰水;C中无明显现象,①中溶液变浑浊;
(4)先通过无水硫酸铜检验水蒸气的存在,因为在验证二氧化碳、一氧化碳的存在时都需通过溶液,可带出水蒸气,影响水蒸气的确定,
故答案为:无水硫酸铜;H2O。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
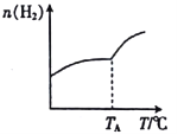
(1)△H____________ (填“>”“<”或“不能确定”)0。
(2)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
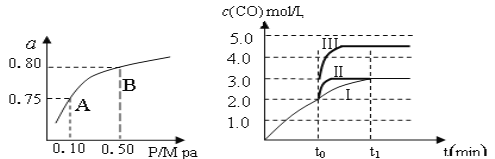
(2)在3 L容积可变的密闭容器中发生反应②,已知
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
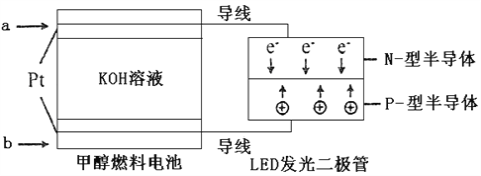
请写出加入(通入)b物质一极的电极反应式_________________;每消耗6.4g甲醇转移的电子数为_______________。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 橙色
橙色![]() 在水中会部分转化为
在水中会部分转化为![]() 黄色
黄色![]() ,该过程可用离子反应方式表示为: ______ ;在
,该过程可用离子反应方式表示为: ______ ;在![]() 溶液中加入足量的NaOH溶液,溶液颜色会完全变成黄色,该过程可用化学反应方式表示为: ______ 。
溶液中加入足量的NaOH溶液,溶液颜色会完全变成黄色,该过程可用化学反应方式表示为: ______ 。
(2)水合草酸晶体的组成可表示为![]() ,为测定x的值,做了如下实验:
,为测定x的值,做了如下实验:
①称取Wg纯草酸晶体,将其配制成100mL水溶液为待测液;
②取25mL待测液放入锥形瓶中,再加入适量的稀![]() ;
;
③用浓度为a![]() 的
的![]() 标准溶液进行滴定
标准溶液进行滴定![]() 滴定过程中有
滴定过程中有![]() 、
、![]() 生成
生成![]() ,
,
请回答:①写出滴定时发生的反应的离子方程式为: ______ ,
②滴定时,将![]() 标准液装在 ______ 式滴定管中,
标准液装在 ______ 式滴定管中,
③假设滴定终点时,用去VmL![]() 溶液,则待测草酸溶液的物质的量浓度为 ______
溶液,则待测草酸溶液的物质的量浓度为 ______ ![]() ,
,
④在上述实验中,下列操作![]() 其他操作正确
其他操作正确![]() 会造成测定结果x值偏高的有 ______
会造成测定结果x值偏高的有 ______ ![]() 填字母
填字母![]() ,
,
A、滴定终点读数时俯视读数B、酸式滴定管使用前,水洗后未用标准液润洗
C、锥形瓶水洗后再用待测液润洗D、滴定时所用的![]() 溶液因久置而导致浓度变小。
溶液因久置而导致浓度变小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
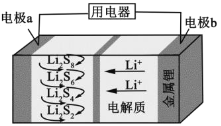
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池充电时间越长,电池中Li2S2的量越多
C.石墨烯的作用主要是提高电极a的导电性
D.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中,正确的是
A. 氯化氢分子的形成过程可用电子式表示为:![]()
B. 16O与 18O的中子数和核外电子排布均不同
C. 稳定性:CH4>SiH4;还原性:HCl>H2S
D. K+、Ca2+、Mg2+的离子半径依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在不同的温度下的平衡常数分别为:
CO2(g)+H2(g)在不同的温度下的平衡常数分别为:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
k | 1.67 | 1.11 | 1.00 | 0.60 |
下列有关叙述不正确的是
A. 该反应平衡常数表达式为K=[c(CO2)·c(H2)]/[c(CO)·c(H2O)]
B. 该反应的逆反应是吸热反应
C. 830℃时,向恒容密闭容器中加入CO2 和H2各1mol,当测得CO2 的物质的量为0.4mol时,反应处于平衡状态
D. 若某温度下该反应中各物质的平衡浓度符合关系式:[c(CO2)/3c(CO)]=[c(H2O)/5c(H2)],则该温度是1000 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol共价键所吸收的能量或形成1 mol共价键所释放的能量称为键能。已知:H—H键能为436 kJ/mol,H—N键能为391 kJ/mol,N2 (g)+ 3H2(g) ![]() 2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
A.H—H比N≡N更牢固
B.N≡N键能约为945.6 kJ/mol
C.合成氨反应选择适当的催化剂是为了提高H2的转化率
D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3═bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是( )
A.由反应可确定:氧化性:HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4Cl2+I2+6H2O═12H++8Cl-+2IO3-
C.若氯酸分解所得混合气体,1 mol混合气体质量为47.6 g,则反应方程式可表示为26HClO3 ═15O2↑+8Cl2↑+10HClO4+8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为20e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com