
”¾ĢāÄæ”湤ŅµÉś²śŅŌNH3ŗĶCO2ĪŖŌĮĻŗĻ³ÉÄņĖŲ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
2NH3 (g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)”£T1”ꏱ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ³äČėNH3ŗĶCO2Ä£Äā¹¤ŅµÉś²ś”£
CO(NH2)2(l)+H2O(l)”£T1”ꏱ£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ³äČėNH3ŗĶCO2Ä£Äā¹¤ŅµÉś²ś”£
£Ø1£©ŌŚĆܱÕČŻĘ÷ÖŠ³äČėNH3ŗĶCO2£¬Ņ»¶ØĢõ¼žÄÜ×Ō·¢½ųŠŠµÄŌŅņŹĒ___________£»
£Ø2£©ČōŌĮĻĘųÖŠµÄNH3ŗĶCO2µÄĪļÖŹµÄĮæÖ®±Č£Ø°±Ģ¼±Č£©![]() £¬ČēÓŅĶ¼ŹĒCO2Ę½ŗā×Ŗ»ÆĀŹ£Ø¦Į£©Óė°±Ģ¼±Č£Øx£©µÄ¹ŲĻµ”£ĘäĖüĢõ¼ž²»±äŹ±£¬¦ĮĖę×ÅxŌö“ó¶ųŌö“óµÄŌŅņŹĒ_________£»
£¬ČēÓŅĶ¼ŹĒCO2Ę½ŗā×Ŗ»ÆĀŹ£Ø¦Į£©Óė°±Ģ¼±Č£Øx£©µÄ¹ŲĻµ”£ĘäĖüĢõ¼ž²»±äŹ±£¬¦ĮĖę×ÅxŌö“ó¶ųŌö“óµÄŌŅņŹĒ_________£»

£Ø3£©µ±x = 2£¬ÉĻŹö·“Ó¦ÖĮ5minŹ±ø÷ĪļÖŹµÄÅØ¶Č²»ŌŁ·¢Éś±ä»Æ£¬ČōĘšŹ¼µÄŃ¹ĒæĪŖP0KPa£¬²āµĆĘ½ŗāĢåĻµŃ¹ĒæĪŖĘšŹ¼Ź±µÄ2/3”£·“Ó¦½įŹųŗó£¬·ÖĄėµĆµ½90gÄņĖŲ”£
¢ŁŹŌ¼ĘĖćøĆ·“Ó¦µÄĘ½¾łĖŁĀŹv (CO2)=_______________£»
¢ŚøĆ·“Ó¦µÄĘ½ŗā³£ŹżK =_________£»
¢Ū“ļµ½Ę½ŗāŗóNH3 µÄĪļÖŹµÄĮæÅضČĪŖ_________”£
”¾“š°ø”æ ĖäČ»”÷S<0£¬Ź¹·“Ó¦²»×Ō·¢£¬µ«”÷H<0Ź¹·“Ó¦×Ō·¢ĒŅÓ°Ļģ³Ģ¶Č“ó£Ø»ņ”÷G<0£¬»ņĘäĖūŗĻĄķ½āŹĶ£© xŌö“ó£¬Ļąµ±ÓŚc(NH3)Ōö“ó£¬CO2×Ŗ»ÆĀŹŌö“ó 0.15mol/L 0.074 3mol/L
”¾½āĪö”æ£Ø1£©2NH3(g)£«CO2(g) ![]() CO(NH2)2(l)£«H2O(l) ”÷H<0£»øł¾Ż”÷G=”÷H-T”÷S<0Ź±×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦ŌŚ”÷S<0£¬”÷H<0Ź±ŅŖÄÜ×Ō·¢½ųŠŠ£¬±ŲŠėŌŚµĶĪĀ·“Ó¦²ÅÄÜ×Ō·¢½ųŠŠ£¬¼“£ŗĖäČ»”÷S<0£¬Ź¹·“Ó¦²»×Ō·¢£¬µ«”÷H<0Ź¹·“Ó¦×Ō·¢ĒŅÓ°Ļģ³Ģ¶Č“ó£»(2) ŌĮĻĘųÖŠµÄNH3ŗĶCO2µÄĪļÖŹµÄĮæÖ®±Č£Ø°±Ģ¼±Č£©
CO(NH2)2(l)£«H2O(l) ”÷H<0£»øł¾Ż”÷G=”÷H-T”÷S<0Ź±×Ō·¢½ųŠŠ£¬Ōņ·“Ó¦ŌŚ”÷S<0£¬”÷H<0Ź±ŅŖÄÜ×Ō·¢½ųŠŠ£¬±ŲŠėŌŚµĶĪĀ·“Ó¦²ÅÄÜ×Ō·¢½ųŠŠ£¬¼“£ŗĖäČ»”÷S<0£¬Ź¹·“Ó¦²»×Ō·¢£¬µ«”÷H<0Ź¹·“Ó¦×Ō·¢ĒŅÓ°Ļģ³Ģ¶Č“ó£»(2) ŌĮĻĘųÖŠµÄNH3ŗĶCO2µÄĪļÖŹµÄĮæÖ®±Č£Ø°±Ģ¼±Č£©![]() =x£¬xŌ½“óĻąµ±ÓŚ¼ÓČėµÄ°±ĘųµÄĮæŌ½¶ą£»Į½ÖÖ·“Ó¦Īļ£¬Ōö¼Ó°±ĘųµÄÅØ¶Č£¬Ę½ŗāÓŅŅĘ£¬¶žŃõ»ÆĢ¼µÄ×Ŗ»ÆĀŹŌö“󣬼“£ŗxŌö“ó£¬Ļąµ±ÓŚc(NH3)Ōö“ó£¬CO2×Ŗ»ÆĀŹŌö“ó£»
=x£¬xŌ½“óĻąµ±ÓŚ¼ÓČėµÄ°±ĘųµÄĮæŌ½¶ą£»Į½ÖÖ·“Ó¦Īļ£¬Ōö¼Ó°±ĘųµÄÅØ¶Č£¬Ę½ŗāÓŅŅĘ£¬¶žŃõ»ÆĢ¼µÄ×Ŗ»ÆĀŹŌö“󣬼“£ŗxŌö“ó£¬Ļąµ±ÓŚc(NH3)Ōö“ó£¬CO2×Ŗ»ÆĀŹŌö“ó£»
£Ø3£©·ÖĄėµĆµ½90gÄņĖŲ£¬ÄņĖŲµÄĮæĪŖ1.5mol£»
2NH3 (g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
ĘšŹ¼£ŗ2a a 0 0
±ä»Æ£ŗ2x x 1.5
Ę½ŗā£ŗ2a-2x a-x 1.5
¢ŁŃ¹ĒæÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±Č£ŗ![]() =
=![]() £¬½āµĆx=
£¬½āµĆx=![]() £¬¶ųøł¾Ż·“Ó¦ÖŠ¶žŃõ»ÆĢ¼ĻūŗĵÄĮæĪŖÄņĖŲÉś³ÉµÄĮææɵĆx=1.5mol£¬ŌņÓŠa=4.5mol£¬v(CO2)=
£¬¶ųøł¾Ż·“Ó¦ÖŠ¶žŃõ»ÆĢ¼ĻūŗĵÄĮæĪŖÄņĖŲÉś³ÉµÄĮææɵĆx=1.5mol£¬ŌņÓŠa=4.5mol£¬v(CO2)=![]() =0.15molL-1min-1£»¢ŚĘ½ŗāŹ±°±ĘųŗĶ¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæÅØ¶Č·Ö±šĪŖ£ŗ
=0.15molL-1min-1£»¢ŚĘ½ŗāŹ±°±ĘųŗĶ¶žŃõ»ÆĢ¼µÄĪļÖŹµÄĮæÅØ¶Č·Ö±šĪŖ£ŗ![]() mol/L =3mol/L”¢
mol/L =3mol/L”¢![]() mol/L =1.5mol/L£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ£ŗK=
mol/L =1.5mol/L£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ£ŗK=![]() =0.074L3mol-3£»¢Ū“ļµ½Ę½ŗāŗóNH3 µÄĪļÖŹµÄĮæÅضČĪŖ£ŗ
=0.074L3mol-3£»¢Ū“ļµ½Ę½ŗāŗóNH3 µÄĪļÖŹµÄĮæÅضČĪŖ£ŗ![]() mol/L =3mol/L”£
mol/L =3mol/Lӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻĶعż·“Ó¦”°SiO2£«2C![]() Si£«2CO”ü”±ÖĘČ”µ„ÖŹ¹č£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
Si£«2CO”ü”±ÖĘČ”µ„ÖŹ¹č£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ×ŌČ»½ēÖŠ¹čŌŖĖŲ¾łŅŌSiO2ŠĪŹ½“ęŌŚ
B. øß“æ¶Č¾§ĢåSiæÉÓĆÓŚÖĘŌģ¹āµ¼ĻĖĪ¬
C. øĆ·“Ó¦Ģõ¼žĻĀCµÄ»¹ŌŠŌ±ČSiĒæ
D. ±ź×¼×“æöĻĀÉś³É4.48 L COŹ±×ŖŅʵē×ÓŹżĪŖ0.4”Į6.02”Į1023
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČĻĀ£¬ŌŚŅ»øö2LµÄĆܱÕČŻĘ÷ÖŠ£¬¼ÓČė4mo1AŗĶ2molB½ųŠŠČēĻĀ·“Ó¦£ŗ
3A(g)+2B(g)![]() 4C(£æ)+2D(£æ)”£·“Ó¦Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā£¬²āµĆÉś³É1.6molC,ĒŅ·“Ó¦µÄĒ°ŗóµÄŃ¹ĒæÖ®±ČĪŖ5:4 £ØĻąĶ¬µÄĪĀ¶ČĻĀ²āĮ棩, ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
4C(£æ)+2D(£æ)”£·“Ó¦Ņ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā£¬²āµĆÉś³É1.6molC,ĒŅ·“Ó¦µÄĒ°ŗóµÄŃ¹ĒæÖ®±ČĪŖ5:4 £ØĻąĶ¬µÄĪĀ¶ČĻĀ²āĮ棩, ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½ŹĒ![]()
B. “ĖŹ±£¬B µÄĘ½ŗā×Ŗ»ÆĀŹŹĒ35%
C. Ōö“óøĆĢåĻµµÄŃ¹Ēæ£¬Ę½ŗāĻņÓŅŅĘ¶Æ»ÆŃ§Ę½ŗā³£ŹżŌö“ó
D. Ōö¼ÓCµÄĮ棬BµÄĘ½ŗā×Ŗ»ÆĀŹ²»±ä
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµĪŖNA£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A. 1L0.1molL©1NH4ClČÜŅŗÖŠ£¬NH4+µÄŹżĮæĪŖ0.1NA
B. 2.4gMgÓėH2SO4ĶźČ«·“Ó¦£¬×ŖŅʵĵē×ÓŹżĪŖ0.1NA
C. ±ź×¼×“æöĻĀ£¬2.24LN2ŗĶO2µÄ»ģŗĻĘųĢåÖŠ·Ö×ÓŹżĪŖ0.2NA
D. 0.1mol H2ŗĶ0.1mol I2ÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ó¦ŗó£¬Ęä·Ö×Ó×ÜŹżĪŖ0.2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Øl£©ŌŚĻĀĮŠŹĀŹµÖŠ£¬Ź²Ć“ŅņĖŲÓ°ĻģĮĖ»Æѧ·“Ó¦µÄĖŁĀŹ£æ
¢ŁČŪČŚµÄKClO3·Å³öĘųÅŻŗÜĀż£¬ČöČėÉŁĮæMnO2ŗÜæģ²śÉśĘųĢå______£»
¢ŚĶ¬ÅØ¶Č”¢Ķ¬Ģå»żµÄŃĪĖįÖŠ·ÅČėĶ¬Ńł“󊔵ĊæĮ£ŗĶĆ¾Į££¬²śÉśĘųĢåÓŠæģÓŠĀż______£»
¢ŪKI¾§ĢåŗĶHgCl2¾§Ģå»ģŗĻŗóĪŽĆ÷ĻŌĻÖĻó£¬ČōŅ»ĘšĶ¶ČėĖ®ÖŠ£¬ŗÜæģÉś³ÉŗģÉ«HgI2______£»
£Ø2£©Ä³Ģ½¾æŠ”×éÓĆ²āĮæHNO3Óė“óĄķŹÆ·“Ó¦¹ż³ĢÖŠÖŹĮæ¼õŠ”µÄ·½·Ø£¬ŃŠ¾æÓ°Ļģ·“Ó¦ĖŁĀŹµÄŅņĖŲ”£ĻŽŃ”ŹŌ¼Į£ŗ1.00 mol/LHNO3”¢2.00 mol/LHNO3£¬ĻøæÅĮ£“óĄķŹÆ”¢“ÖæÅĮ£“óĄķŹÆ£¬35”ęĖ®Ō””£
¢ŁĒėøł¾ŻÄܽųŠŠµÄĢ½¾æÄŚČŻ£¬ĢīŠ“ŅŌĻĀŹµŃéÉč¼Ę±ķ£¬Ķź³ÉĢ½¾æŹµŃé£ŗ
ŹµŃ鱹ŗÅ | T”ę | “óĄķŹÆ¹ęøń | HNO3ÅØ¶Č£Ømol/L£© |
A | ³£ĪĀ | 2.00 | |
B | “ÖæÅĮ£ | 1.00 | |
C | “ÖæÅĮ£ | 2.00 | |
D | ĻøæÅĮ£ | 2.00 |
¢ŚÕūøöŹµŃéÖŠÓ¦æŲÖĘµÄ²»±äĮæŹĒĻõĖįČÜŅŗĢå»żŗĶ______”£
¢ŪøĆŹµŃ銔×éÓĆČēÓŅĶ¼ŹµŃé×°ÖĆ½ųŠŠŹµŃ锣

a£®³żµē×ÓĢģĘ½”¢øÉŌļ¹Ü”¢×¶ŠĪĘ攢Ņ©³×”¢½ŗČūµČŅĒĘ÷Ķā£¬±ŲŠčµÄŹµŃéŅĒĘ÷»¹ÓŠ______”£
b£®Čō·“Ó¦æŖŹ¼Ź±µē×ÓĢģĘ½¶ĮŹżĪŖ100.00g£¬¾2·ÖÖÓ·“Ó¦½įŹųŹ±µÄ¶ĮŹżĪŖ95.60g£¬ŌņÕāĮ½·ÖÖÓÄŚÓĆCaCO3Ą“±ķŹ¾µÄĖŁĀŹĪŖ_____g/min”£
c£®Čō³·³żøÉŌļ¹Ü×°ÖĆ£¬Ėł²āĖŁĀŹ______£ØĢī”°Ę«“ó”±”¢”°Ę«Š””±»ņ”°²»±ä”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÖŠ²»ÕżČ·µÄŹĒ
A. Ķ¬·ÖŅģ¹¹ĢåµÄ»ÆѧŠŌÖŹ²»Ņ»¶ØĻąĶ¬ B. Ķ¬ĖŲŅģŠĪĢåµÄ»ÆѧŠŌÖŹ²»Ņ»¶ØĻąĶ¬
C. Ķ¬Ī»ĖŲŌ×ӵĻÆѧŠŌÖŹ²»Ņ»¶ØĻąĶ¬ D. Ķ¬ĻµĪļµÄĪļÖŹĪļĄķŠŌÖŹ²»Ņ»¶ØĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æT ”ꏱ£¬ŌŚ2 LµÄĆܱÕČŻĘ÷ÖŠ£¬ĘųĢåX”¢YŗĶZČżÖÖĪļÖŹµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£¬ĻĀĮŠĆčŹöÕżČ·µÄŹĒ
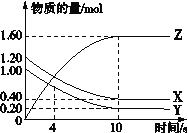
A£®ČŻĘ÷ÖŠ»Æѧ·“Ó¦ĪŖX(g)£«Y(g)![]() Z(g)
Z(g)
B£®0”«10 s£¬X±ķŹ¾µÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ0.04 mol/(L”¤s)
C£®Ź¹ÓĆ“ß»Æ¼ĮÖ»ÄܼÓæģ0”«10 s¼äµÄ·“Ó¦ĖŁĀŹ
D£®0”«4 sµÄĘ½¾ł·“Ó¦ĖŁĀŹŠ”ÓŚ0”«10 sµÄĘ½¾ł·“Ó¦ĖŁĀŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠŗ¬Ō×ÓŹż×ī¶ąµÄŹĒ£Ø £©
A. 6.4g O2 B. 8.8g CO2 C. 0.1mol N2 D. 3.01”Į1022øöH2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ(””””)
A. ĖįÓė“¼ŌŚĒæĖįµÄ“ęŌŚĻĀ¼ÓČČ£¬æɵƵ½õ„
B. ŅŅĖįŗĶ¼×“¼·¢Éśõ„»Æ·“Ӧɜ³É¼×ĖįŅŅõ„
C. õ„»Æ·“Ó¦µÄÄę·“Ó¦ŹĒĖ®½ā·“Ó¦
D. ¹ūĄąŗĶ»Ø²ŻÖŠ“ęŌŚ×Å·¼ĻćĘųĪ¶µÄµĶ¼¶õ„
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com