
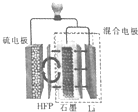
 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减少,阴极质量增加 | |
| C. | 放电时,正极的电极反应式为S62-+10e-=6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |
分析 根据电池反应式知,放电时,Li元素化合价由0价变为+1价,则Li是负极,S电极是正极,负极反应式为Li-e-=Li+,正极电极反应式为Li2S6+10Li++10e-=6Li2S,充电时,阳极、阴极电极反应式与正极、负极电极反应式正好相反,Li性质较活泼,极易和水反应生成LiOH和氢气,放电时,阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:根据电池反应式知,放电时,Li元素化合价由0价变为+1价,则Li是负极,S电极是正极,负极反应式为 Li-e-=Li+,正极反应式为Li2S6+10Li++10e-=6Li2S,充电时,阳极、阴极电极反应式与正极、负极电极反应式正好相反,
A.放电时,阳离子向正极移动、阴离子向负极移动,所以锂离子向正极移动,故A错误;
B.充电时,阳极电极反应式为6Li2S-10e-=Li2S6+10Li+,阳极质量减少,阴极电极反应式为Li++e-=Li,所以阴极质量增加,故B正确;
C.放电时,正极上得电子发生还原反应,正极电极反应式为Li2S6+10Li++10e-=6Li2S,故C错误;
D.Li极易和水反应生成LiOH和氢气,从而导致S62-无法反应,故D错误;
故选B.
点评 本题考查化学电源新型电池,为高考高频点,侧重考查原电池原理及电极反应式的书写,难点是电极反应式书写,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | 全部由非金属元素构成的化合物中肯定不存在离子键 | |
| B. | 所有物质中都存在化学键 | |
| C. | 已知乙炔的结构式为CH≡CH,则乙炔中σ键和π键之比为3:2 | |
| D. | 乙炔分子中只存在σ键,不存在π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
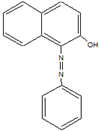 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )| A. | 它属于芳香烃 | B. | 它的分子式为C16H13ON2 | ||
| C. | 它能发生取代反应和加成反应 | D. | 它与苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某白色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滴定管装标准液时应先水洗后用标准液润洗再装入标准液 | |
| B. | 锥形瓶用作反应容器时一定不能加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏瓶支管口 | |
| D. | 萃取实验中振荡分液漏斗时,应关闭其玻璃塞并打开活塞 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com