
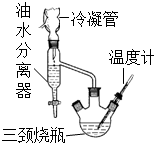
 乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:
乳酸乙酯(2-羟基丙酸乙酯)常用于调制果香型、乳香型食用和酒用香精.为了在实验室制取乳酸乙酯,某研究性学习小组同学首先查阅资料,获得下列信息:| 物质 | 水 | 乙醇 | 乳酸 | 苯 | 乳酸乙酯 |
| 沸点/℃ | 100 | 78.4 | 122 | 80.10 | 154 |
分析 (1)酯化反应过程中需要浓硫酸作催化剂和吸水剂;形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;油水分离器中液体不再变化说明反应结束;
(2)水洗的目的主要是除去催化作用的硫酸,因此洗涤液显酸性;
(3)乳酸乙酯分子的结构简式为CH3CH(OH)COOCH2CH3,分子中有5种不同环境的氢原子.
解答 解:(1)酯化反应利用浓硫酸作催化剂和吸水剂,故缺少浓硫酸,酯化反应是可逆反应,混合物中添加苯可形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行,如果收集装置中液体的量不再增加说明反应已经完全,
故答案为:浓硫酸;形成水、乙醇、苯共沸物,分离反应生成的水,促进酯化反应正向进行;油水分离器中液体不再增加;
(2)最后一次洗涤液不显酸性,可说明洗涤完全,因此只要测定一下最后一次水洗液的pH到7即可判断,故答案为:测定水洗液的pH至7;
(3)乳酸乙酯分子的结构简式为CH3CH(OH)COOCH2CH3,分子中有5种不同环境的氢原子,乳酸乙酯分子核磁共振氢谱中有5个峰,
故答案为:5.
点评 本题考查有机物制备实验,涉及酯化反应、物质的分离提纯、平衡移动原理应用、对信息的获取与运用、实验基本操作、核磁共振氢谱等,难度中等.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| B. | 利用重结晶可对粗苯甲酸进行提纯 | |
| C. | 不能用核磁共振氢谱来鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L Na2CO3溶液中,CO32-的数目小于0.1NA个 | |
| B. | 标准状况下,6.0 g乙酸含有0.3 NA个C-H键 | |
| C. | 32gCu与足量硫黄充分反应,转移NA个电子 | |
| D. | 31g白磷(P4)中含有6 NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:
Al、Ti、Fe、Cu是几种常见的重要金属.根据要求回答下列问题:| 元素 | A | B | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{t_1}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com