
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
【答案】B
【解析】M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-═O2↑+4H+,故A正确;原料室中的B(OH)4-通过b膜进入产品室、Na+通过c膜进入N室,M室中氢离子通入a膜进入产品室,则a、c为阳离子交换膜,b为阴离子交换膜,故B错误 ;N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的钠离子通过c膜进入N室,溶液中c(NaOH)增大,所以N室:a%<b%,故C正确;理论上每生成1mol产品,M室生成1molH+,转移电子1mol,M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,N室生成0.5molH2,M室生成0.25mol氧气,两极室共产生标准状况下16.8 L气体,故D正确。


科目:高中化学 来源: 题型:
【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:
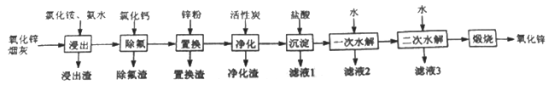
已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn Pb Cu Cl F |
质量分数/% | 59.78 9.07 0.30 2.24 1.80 |
II.“浸出”时,大部分锌元素以Zn(NH3)42+ 形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)Zn的原子序数为30,其在元素周期表中的位置为__________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_______________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol·L-1,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F- 沉淀完全即溶液中c(F-)<10-5 mol·L-1,则所加氯化钙溶液的浓度度最小为_____________。已知:Ksp((CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭的_________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为_________________________________。
(6)将滤液1和滤液2合并,经浓缩后,可返回至__________(填流程中的操作名称)循环利用。
(7)“一次水解”时,产物为Zn(OH)xCly,。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1 g(假设各步均转化完全)。则一次水解产物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
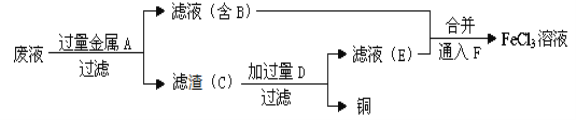
①滤渣C的化学式为_____________。
②通入F发生反应的化学方程式为_________________________。
③要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
a.加入足量氯水b.加入足量KMnO4溶液 c.加入少量KSCN溶液
A.ac B.cb C.ca D.abc
(2)四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是:
3Fe2++2S2O32-+O2+xOH- ═Fe3O4↓+S4O62-+2H2O.请回答下列问题.
①水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________.
②反应的化学方程式中x=______.
③每生成1molFe3O4,反应转移的电子为____________mol,被Fe2+还原的O2的物质的量为______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用越来越受到人们的关注。
(1)基态Ti原子核外电子排布的最高能级符号是________。与钛同周期元素中,基态原子的未成对电子数与钛相同的有_______种。
(2)钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是_________
(3)催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
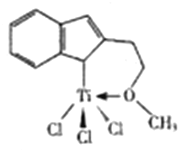
①M中,碳原子的杂化形式有__________种。
②M中,不含___________(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
(4)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
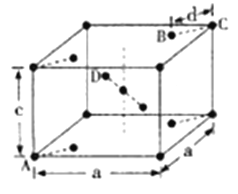
①4个微粒A、B、C、D中,属于氧原子的是______
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,___________,_____________);钛氧键键长d=_________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(b)由于其特殊的结构,一直受到结构和理论化学家的注意,根据其转化关系,下列说法正确的是
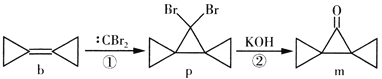
A. b的所有原子都在一个平面内
B. p在氢氧化钠的乙醇溶液中加热生成烯烃
C. m的同分异构体中属于芳香族化合物的共有5种
D. 反应①是加成反应,反应②是消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为P-P:a kJ·mol-1、P—O:b kJ·mol-1、P===O:c kJ·mol-1、O===O:d kJ·mol-1。根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )

A. (6a+5d-4c-12b) kJ·mol-1
B. (4c+12b-6a-5d) kJ·mol-1
C. (4c+12b-4a-5d) kJ·mol-1
D. (4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取10.6g Na2CO3溶于水配成100ml溶液,求:
(1)Na2CO3物质的量_______。
(2)Na2CO3溶液的物质的量浓度_______。
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.4mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com