
分析 依据宝石辈翠中的各元素质量分数除以各自相对原子质量计算各种元素原子个数之比,据此写出去化学式.
解答 解:某种宝石辈翠中的元素质量分数是:Be(铍)5.06%,Al 10.05%、Si 31.48%、O 53.41%,则其原子个数之比为:$\frac{5.06%}{9}$:$\frac{10.05%}{27}$:$\frac{31.48%}{28}$:$\frac{53.41%}{16}$=3:2:6:18,用氧化物形式表示其组成:3BeO•Al2O3•6SiO2;
故答案为:3BeO•Al2O3•6SiO2;
点评 本题考查了物质化学式的确定,明确物质的组成及常见元素化合价是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14CO2的结构式为O═14C═O | B. | 14CO2和12CO2互为同分异构体 | ||
| C. | 14C和12C互为同素异形体 | D. | 14CO2和Na218O2反应生成15O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 实验方案 |
| A | 验证苯与液溴在溴化铁催化条件下发生的是取代反应 | 将产生的气体物质通入水中,滴入石蕊试液 |
| B | 检验火柴头中氯元素的存在 | 取几根火柴头浸入水中,片刻后再取少量溶液于试管中,滴加硝酸银溶液和稀硝酸 |
| C | 验证Ksp(AgI)<Ksp(AgCl) | 向1L浓度均为0.5mol•L-1NaCl、KI的混合液中滴加AgNO3溶液 |
| D | 配置0.1000mol•L-1CuSO4溶液 | 将12.00g CuSO4•5H20溶于水配成480mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
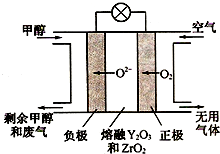 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H
铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广泛.铁还有很多的化合物及其化学反应,如铁与水的反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com