
| A. | 铜 | B. | 二氧化碳 | C. | 金刚石 | D. | 氯化钠 |
分析 根据金属、大多数固态非金属单质、稀有气体等由原子构成;有些物质是由分子构成的,气态的非金属单质和由非金属元素组成的化合物,如氢气、水等;有些物质是由离子构成的,一般是含有金属元素和非金属元素的化合物,如氯化钠,进行分析判断即可.
解答 解:A、铜属于金属单质,是由铜原子直接构成的,故A错误.
B、二氧化碳属于气态化合物,是由二氧化碳分子构成的,故B错误.
C、金刚石属于固态非金属单质,是由碳原子直接构成的,故C错误.
D、氯化钠是由钠离子和氯离子构成的,故D正确.
故选:D.
点评 本题难度不大,主要考查了构成物质的微观粒子方面的知识,对物质进行分类与对号入座、掌握常见物质的粒子构成是正确解答本题的关键.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量的NaOH固体已经潮解 | |
| B. | 洗涤后的容量瓶中留有少量蒸馏水 | |
| C. | 转移溶解液时,溶解液未冷却至室温 | |
| D. | 定容时俯视容量瓶的刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
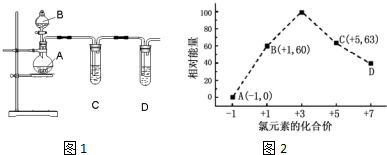
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金材料中可能含有非金属元素 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,使雨水pH=5.6,形成酸雨 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
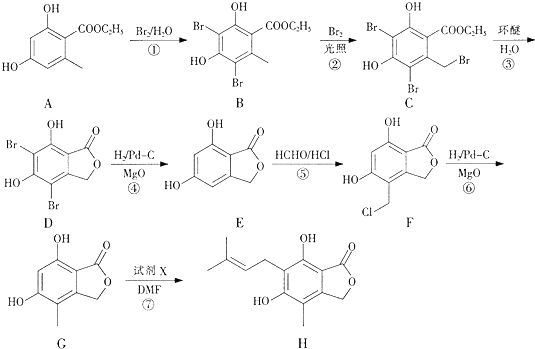
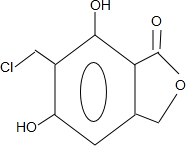 (任写一种).
(任写一种).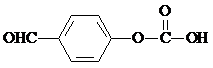 或
或 .
.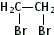
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2O7、P2O5、SO3、CO2、NO2均属于酸性氧化物 | |
| B. | K2O、K2O2、KO2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| C. | 根据能否发生丁达尔效应,可以区分胶体和溶液 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
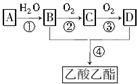 已知:①A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如下:
已知:①A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com