
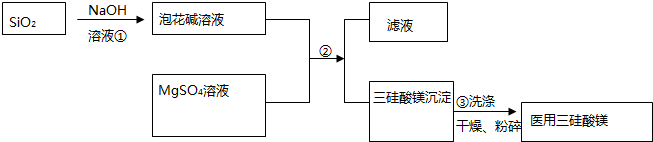
分析 (1)SiO2与NaOH反应生成Na2SiO3;将直径为1~100nm的SiO2颗粒分散到丙酮中形成胶体;
(2)NaClO溶液将Mn2+氧化为MnO2;
(3)过滤操作装置为 ,其中A、B、C为玻璃仪器;制备Mg2Si3O8•nH2O时,用到gSO4,沉淀混有SO42-,检验SO42-判断沉淀洗涤情况;
,其中A、B、C为玻璃仪器;制备Mg2Si3O8•nH2O时,用到gSO4,沉淀混有SO42-,检验SO42-判断沉淀洗涤情况;
(4)三硅酸镁中和HCl反应的化学方程式为:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,设0.184gMgSi3O8•nH2O的物质的量是x,列式计算;
若在滴定结束时仰视读数,V(NaOH)读数偏大,测定剩余的盐酸偏大,与三硅酸镁反应的盐酸偏小,x值偏小,n值偏高.
解答 解:(1)SiO2与NaOH反应生成Na2SiO3,则泡花碱溶液的溶质为Na2SiO3;将直径为1~100nm的SiO2颗粒分散到丙酮中形成胶体;
故答案为:Na2SiO3;胶体;
(2)NaClO溶液将Mn2+氧化为MnO2,离子方程式为Mn2++ClO-+H2O=MnO2↓+Cl-+2H+;
故答案为:Mn2++ClO-+H2O=MnO2↓+Cl-+2H+;
(3)过滤操作装置为 ,其中A、B、C为玻璃仪器;制备Mg2Si3O8•nH2O时,用到gSO4,沉淀混有SO42-,步骤③中,取洗涤液少许于试管中,加入几滴BaCl2溶液,若不产生白色沉淀,则沉淀已洗涤干净;
,其中A、B、C为玻璃仪器;制备Mg2Si3O8•nH2O时,用到gSO4,沉淀混有SO42-,步骤③中,取洗涤液少许于试管中,加入几滴BaCl2溶液,若不产生白色沉淀,则沉淀已洗涤干净;
故答案为: ;取洗涤液少许于试管中,加入几滴BaCl2溶液,若不产生白色沉淀,则沉淀已洗涤干净;
;取洗涤液少许于试管中,加入几滴BaCl2溶液,若不产生白色沉淀,则沉淀已洗涤干净;
(4)三硅酸镁中和HCl反应的化学方程式为:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,
根据化学方程式,设0.184gMgSi3O8•nH2O的物质的量是x,得
MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O
1 4
x 0.050L×0.1mol/L-0.030L×0.1mol/L,
解得x=0.0005mol,所以MgSi3O8•nH2O的摩尔质量是$\frac{0.184g}{0.0005mol}$=368g/mol,Mg2Si3O8的摩尔质量为260g/mol,所以18n=108,即n=6;
若在滴定结束时仰视读数,V(NaOH)读数偏大,测定剩余的盐酸偏大,与三硅酸镁反应的盐酸偏小,x值偏小,n值偏高;
故答案为:6;偏高.
点评 本题考查制备Mg2Si3O8•nH2O,要求学生具有分析和解决问题的能力,难度大.


科目:高中化学 来源: 题型:多选题
| A. | 反应过程中,若降低压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则平衡时,吸收热量为QkJ | |
| C. | 将反应的温度由T1升高至T2,则反应的平衡常数K1>K2 | |
| D. | 当反应吸收热量为0.25QkJ时,生成的HCl恰好能与1 molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
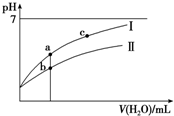 已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:丙烯、氯乙烯、苯 | 分子内所有原子均在同一平面 |
| B | 由溴丙烷水解制丙醇、由丙烯与水反应制丙醇 | 属于同一反应类型 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | C4H9Cl的同分异构体数目(不考虑立体异构) | 共有4种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O2-离子结构示意图: | B. | NH4Cl的电子式: | ||
| C. | 含78个中子的碘的核素:53131I | D. | 二氧化硅的分子式:SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林过量出现水杨酸(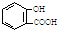 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: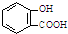 +2HCO3-→ +2HCO3-→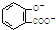 +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| B. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnSO4 | B. | NaHCO3 | C. | NaHSO4 | D. | Fe(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com