
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)观察表格中发现NH4+水解显酸性;根据溶液中电荷守恒计算H+离子浓度再求pH值;
(2)①已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ•mol-1,②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5kJ•mol-1,利用盖斯定律,将②-①可得焦炭与水蒸气反应的热化学方程式;
②二氧化硫是一种酸性氧化物可以和碱反应,二氧化硫溶于水得亚硫酸,酸性强于碳酸,所以可以和碳酸钠溶液反应;
(3)①计算出平衡时各种物质的物质的量,结合平衡常数K=$\frac{c{\;}^{2}(NO)}{c(N{\;}_{2})c(O{\;}_{2})}$计算;该反应为吸热反应,则温度升高,反应速率加快,平衡向吸热方向即右移动;
②根据G=△H-T•△S判断反应能否自发进行;
③CO和NO在催化剂发生反应生成无污染的气体CO2和N2.
解答 解:(1)观察表格中发现NH4+水解显酸性,所以PM2.5的酸碱性为酸性,溶液中电荷守恒:C(K+)+C(NH4+)+c(Na+)+C(H+)=2C(SO42-)+C(NO3-)+C(Cl-),4×10-6mol/L+2×10-5mol/L+6×10-6mol/L+C(H+)=2×4×10-5mol/L+3×10-5mol/L+2×10-5mol/L,得C(H+)=1×10-4mol•L-1,pH=-lg[H+]=4,
故答案为:酸性;4;
(2)①已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,
所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1,
故答案为:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1;
②a.二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O,可以用氢氧化钙吸收二氧化硫,故a正确;
b.二氧化硫水溶液是亚硫酸所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑,可以用碳酸钠溶液做洗涤剂,故b正确;
c.二氧化硫与氯化钙溶液不反应,不能用氯化钙溶液吸收二氧化硫,故c错误;
d.二氧化硫与NaHSO3溶液不反应,不能用NaHSO3溶液吸收二氧化硫,故d错误;
故选:ab;
(3)①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8mol N2和0.2mol O2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,反应前后气体物质的量相同,计算平衡常数时可以用物质的量代替平衡浓度计算,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,书写计算得K=$\frac{c{\;}^{2}(NO)}{c(N{\;}_{2})c(O{\;}_{2})}$=$\frac{(8×10{\;}^{-4}mol){\;}^{2}}{(0.8-4×10{\;}^{-4})mol×(0.2-4×10{\;}^{-4})mol}$=4×10-6,
气缸温度越高,单位时间内NO排放量越大,原因是该反应为吸热反应,则温度升高,反应速率加快,平衡向吸热方向即右移动;
故答案为:4×10-6;该反应为吸热反应,则温度升高,反应速率加快,平衡向吸热方向即右移动;
②2CO(g)=2C(s)+O2(g)是一个熵值减小的反应即:△S<0,同时又是一个△H>O,所以△H-T•△S一定大于0,所以任何条件下不能自发进行,
故答案为:因为该反应的△H>0,△S<0,所以任何温度下均不自发进行;
③CO和NO在催化剂发生反应生成无污染的气体CO2和N2,方程式为2CO+2N0 $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2,故答案为:2CO+2N0 $\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
点评 本题综合考查化学反应原理的基础知识,涉及离子的水解、PH值的计算、盖斯定律的应用、化学平衡常数的计算、自由能的应用等,题目难度中等,注意相关知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.75 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 0.15 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 弱电解质的导电能力一定比强电解质的导电能力弱 | |
| B. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液显碱性 | |
| C. | 豆浆中加入硫酸钙会使蛋白质聚沉. | |
| D. | 同浓度的①NaHCO3②Na2CO3③CH3COONa四种溶液,pH值大小排列顺序是②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化不一定都是化学反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量总是大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成水22g,其中所含的中子数为11NA | |
| B. | 分子数为NA的N2、CO混合气体体积为22.4L,质量为28g | |
| C. | 标准状况下,22.4LNO和11.2LO2混合后气体的原子总数为3NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
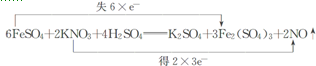 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
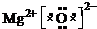 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操 作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中不再产生气泡,试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液. | 试管A、B中均未见气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L Cl4中含CL原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子书为0.3NA | |
| D. | 常温常压下10g46%酒精溶液中含氧原子总数为 0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com