
【题目】由于燃料电池汽车,尤其氢燃料电池汽车可以实现零污染排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,燃料电池汽车成为近年来汽车企业关注的焦点。为了获得竞争优势,各国纷纷出台政策,加速推进燃料电池关键技术的研发。燃料电池的燃料选择有氢气、甲醇等。
(1)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(1) △H=-285kJ/mol ①
CH3OH(l)十![]() O2(g)=CO2(g)+2H2O(1) △H=-726.0 kJ/mol ②
O2(g)=CO2(g)+2H2O(1) △H=-726.0 kJ/mol ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:________________。
(2)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇-空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①这个电池的负极发生的反应是_____________。
②在稀土氧化物的固体电解质中,O2-的移动方向是_____________。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是________________。
【答案】 CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=+298.5 kJ·mol-1 CH3OH+3O2--6e-===CO2↑+2H2O 正极流向负极 燃料电池的能量转化率高
【解析】(1)2H2(g)+O2(g)=2H2O(1) △H=-285kJ/mol ①,CH3OH(l)十![]() O2(g)=CO2(g)+2H2O(1) △H=-726.0 kJ/mol ②,依据盖斯定律①×3-②×2得到:2CO2 (g)+6H2 (g)=2CH3OH(l)+2H2O (l)△H=+597kJ/mol;热化学方程式为:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=+298.5 kJ·mol-1;(2)①甲醇一空气燃料电池中氧气得到电子发生还原反应生成氧离子,电极反应为:O2+4e-=2O2-; 甲醇在负极失电子发生氧化反应,电极反应为:CH3OH+3O2--6e-===CO2↑+2H2O;②依据电极反应分析可知原电池中阴离子移向负极,氧离子从正极流向负极移动;③原电池反应实现能量转化的高效率,燃料电池能量转化率高。
O2(g)=CO2(g)+2H2O(1) △H=-726.0 kJ/mol ②,依据盖斯定律①×3-②×2得到:2CO2 (g)+6H2 (g)=2CH3OH(l)+2H2O (l)△H=+597kJ/mol;热化学方程式为:CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=+298.5 kJ·mol-1;(2)①甲醇一空气燃料电池中氧气得到电子发生还原反应生成氧离子,电极反应为:O2+4e-=2O2-; 甲醇在负极失电子发生氧化反应,电极反应为:CH3OH+3O2--6e-===CO2↑+2H2O;②依据电极反应分析可知原电池中阴离子移向负极,氧离子从正极流向负极移动;③原电池反应实现能量转化的高效率,燃料电池能量转化率高。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】如表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | Na2O2 | NaOH | NaCl | ①常温遇水 |
B | Al2O3 | NaAl(OH)4 | Al(OH)3 | ②通入CO2 |
C | NO | NO2 | HNO3 | ④加入铜粉 |
D | C | CO | CO2 | ③点燃镁条 |
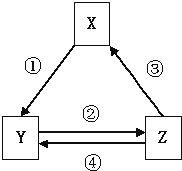
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率和化学反应限度的说法中正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度,即使条件改变,该限度都不会改变
D.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键、共价键的叙述中,正确的是
A. 在离子化合物里,只存在离子键,没有共价键
B. 在共价化合物分子内,一定不存在离子键
C. 只含非金属元素的化合物一定是共价化合物,
D. 由多种元素组成的多原子分子里,一定只存在极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程和实验装置如下: 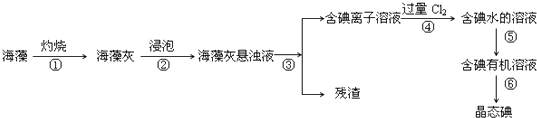
(1)写出步骤④对应反应的离子方程式: .
(2)步骤④除了加入过量Cl2 , 下列氧化剂最好选用(填代号).
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是 .
(3)步骤⑤中,某学生选择用苯提取碘的理由是 .
(4)设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关煤的说法中不正确的是
A.煤是工业上获得芳香烃的重要来源
B.开发新能源,减少燃煤,是控制酸雨,保护环境的有效途径之一
C.煤、石油、水煤气均是可再生能源
D.煤的干馏和石油的裂解过程均属于化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( ) 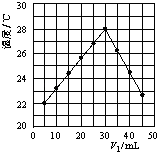
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 摩尔是七个基本物理量之一 B. 阿伏加德罗常数是没有单位的
C. 1molH2O约含有6.02×1023 个水分子 D. 氮气的摩尔质量是28g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com