


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:Y>Z>W |
| B、Y的最高价氧化物对应的水化物为强碱 |
| C、对应氢化物的热稳定性:HmZ<HnW |
| D、XW2分子中各原子最外层电子未均达到8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、(W-B)
| ||
B、(W-B)
| ||
C、(W-B)
| ||
D、(W-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=2,n=1 |
| B、m=1,n=3 |
| C、m=1,n=2 |
| D、m=3n=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)?CH3OH(g)+、H2O(g)△H1 回答下列问题.
Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g)?CH3OH(g)+、H2O(g)△H1 回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
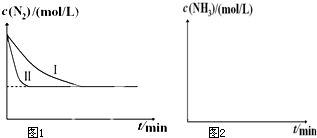 (1)已知:N2(g)+O2(g)═2NO(g)△H1
(1)已知:N2(g)+O2(g)═2NO(g)△H1| 温度/℃ | 起始量/mol | 平衡量/mol[学科 | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
| 一定条件 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com