
| A、充电时,阳极的电极反应式为:2Br--2e-=Br2 |
| B、放电时,负极的电极反应式为:Zn-2e-=Zn2+ |
| C、放电时,Zn2+ 移向负极 |
| D、电解质溶液不可以用强碱,也不可以用强酸 |


科目:高中化学 来源: 题型:
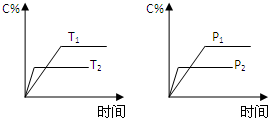 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,若升温,平衡左移 |
| B、达平衡后,加入催化剂则C%增大 |
| C、化学方程式中a+b>c+d |
| D、达平衡后,减少A的量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 10%硫酸的体积(mL) | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 20 | |
| Ⅳ | 2mL | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、92.4 kJ |
| B、92.4 kJ~184.8 kJ |
| C、小于184.8 kJ |
| D、184.8 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35.5g超氧化钾(KO2)所含的阴离子中电子数为8NA |
| B、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| C、常温常压下,92g NO2和N2O4混合气体中含有的原子数为6NA |
| D、工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com