
| A、加水稀释时,溶液中c(OH-)增大,其余离子浓度均减小 | ||
B、
| ||
| C、c(Na+)>c(Cl-)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | ||
| D、c(Cl-)=c(HC2O4-)+2c(C2O42-)+c(HC2O4) |
| 1 |
| 2 |


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:

| A、装置甲不能防止铁钉生锈 |
| B、装置乙可除去乙烯中混有的乙炔 |
| C、装置丙可用于实验室制取乙酸乙酯 |
| D、装置丁可用于收集H2、CO2、Cl2、HCl、NO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、原子半径:rW>rZ>rY |
| B、Y形成的离子与W形成的离子的电子数不可能相同 |
| C、化合物X2Y、ZY、WY3中化学键的类型相同 |
| D、由X、Y、Z、W组成的化合物的水溶液可能显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质能从M与R元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离氢氧化铁胶体和氯离子 | 盐析 | 胶体不能透过半透膜,离子能 |
| B | 分离植物油和水的混合物 | 分液 | 二者互不相溶且密度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 除去乙醇中的乙酸 | 蒸馏 | 乙醇与乙酸沸点相差较大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离出的c(H+)?c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32- |
| B、澄清透明溶液:Mg2+、Cu2+、Cl-、SO42- |
| C、使酚酞变红色的溶液:NH4+、K+、AlO2-、NO3- |
| D、含0.1mol?L-1 KI的溶液:Fe3+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| (1) | (2) | (3) | (4) | (5) | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸铵 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
| A、五种溶液中,水电离出的c(OH-)最小的是⑤ |
| B、将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>③>④ |
| D、在⑤中加入适量的④至溶液呈中性,所得溶液中:c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
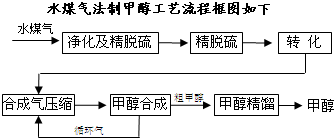 将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.| 高温 |
| 3 |
| 2 |
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com