
| A. | Li、Be、B原子最外层电子数逐渐增多 | |
| B. | N、O、F原子半径依次增大 | |
| C. | Li、Na、K的金属性依次减弱 | |
| D. | P、S、Cl最高正价依次升高 |
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑧ | C. | ③⑤ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸和乙醇都属烃类化合物 | |
| B. | 有机化合物一定含有碳元素 | |
| C. | 丙烷和丁烷都有同分异构体 | |
| D. | 燃烧生成CO2和H2O的物质不一定是烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热浓氨水 | B. | 加热NH4Cl固体 | ||
| C. | 加热NH4Cl和Ca(OH)2的混合物 | D. | 加热H2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
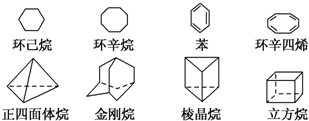 如图是八种环状的烃类物质:
如图是八种环状的烃类物质: 1,4-二甲苯、
1,4-二甲苯、 1,3,5-三甲苯.
1,3,5-三甲苯.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 将等物质的量的Cl2和CH4混合气体A.
将等物质的量的Cl2和CH4混合气体A.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com