
| A. | NH4+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、Cl-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、NO3- | D. | Na+、Ca2+、Cl-、AlO2- |
分析 常温下,水电离的c (H+)=1×10-13 mol•L-1的无色溶液,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发动氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
解答 解:常温下,水电离的c (H+)=1×10-13 mol•L-1的无色溶液,为酸或碱溶液,
A.碱溶液中不能大量存在NH4+、Mg2+,故A不选;
B.酸、碱性溶液中该组离子之间不反应,可大量共存,故B选;
C.碱性溶液中不能大量存在Al3+、Cu2+,故C不选;
D.酸溶液中不能大量存在AlO2-,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
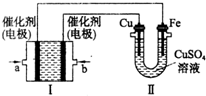 如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.
如图所示,装置1为甲烷燃料电池(电解质溶液为KOH溶液),通过装置II实现铁棒上镀铜.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得某溶液的pH为0 | |
| B. | 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝 | |
| C. | 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中 | |
| D. | 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.36mLNaOH 溶液 | |
| B. | 用托盘天平称取6.85g食盐 | |
| C. | 用标准的盐酸滴定未知浓度的NaOH 溶液,用去盐酸21.10mL | |
| D. | 用广泛pH 试纸测得某溶液pH 为5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将可调高度的铜丝伸入稀硝酸中,溶液变蓝,说明Cu与稀硝酸发生置换反应 | |
| B. | 稀硝酸可除去试管内壁的银镜 | |
| C. | 常温下,将浓硝酸滴加到用砂纸打磨过上,会产生红棕色气体 | |
| D. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,则会有气体生成,溶液呈红色,说明稀硝酸将Fe氧化为Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
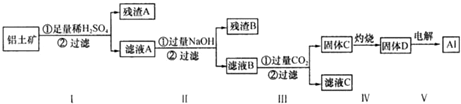
| A. | 滤液A 可用于净水,其净水原理为Al3++3H2O═Al(OH)3+3H+ | |
| B. | 固体C→固体D 的操作过程中主要仪器是酒精灯、蒸发皿、玻璃棒 | |
| C. | 滤液C 中存在以下关系:c(Na+)=c(SO42-)+2 c(CO32-)+c(HCO3-)+c(OH-)-c(H+) | |
| D. | 若在100 mL 滤液B 中加入1 mol•L-1HCl 200 mL,沉淀达到最大且质量为11.7 g,则滤液B 中c(Na+)大小2 mol•L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com