
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| x值 | 剩余气体 | |
| 化学式 | 物质的量/摩 | |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列关于其说法正确的是( )
,下列关于其说法正确的是( )| A、分子中碳原子与氮原子的个数比是7:5 |
| B、属于芳香族化合物 |
| C、能与氢氧化钠溶液反应,但不能与盐酸反应 |
| D、属于苯酚的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置可用于测定中和热 |
B、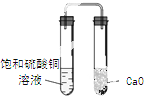 装置久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
C、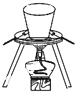 装置在胆矾中结晶水的测定实验中用于灼烧胆矾 |
D、 装置可用于吸收易溶于水的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| nB |
| 2tB |
查看答案和解析>>
科目:高中化学 来源: 题型:
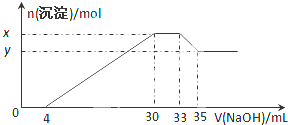 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A、x与y的差值为0.1mol |
| B、原溶液中c(Cl-)=0.75 mol?L-1 |
| C、原溶液的c(H+)=0.1 mol?L-1 |
| D、原溶液中n(Mg2+):n(Al3+)=5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
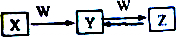 X、Y、Z三种物质中均含有相同的某种元素,它们之间具有如图转化关系(反应条件和其他生成物已省去),请回答下列问题:
X、Y、Z三种物质中均含有相同的某种元素,它们之间具有如图转化关系(反应条件和其他生成物已省去),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com