
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | ① | 420 | ② | 7 | 9 |
| Ⅲ | 探究催化剂对该反应速率的影响 | ③ | 10 | 7 | 9 |
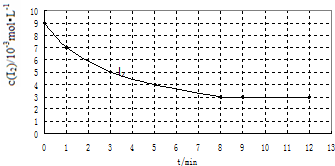
分析 (1)探究某一探究对反应速率的影响时,除了该条件不同外,其它条件必须完全相同,据此进行解答;
(2)①根据0~5min内碘单质的浓度变化计算出反应速率,v=$\frac{△c}{△t}$;
②平衡常数K=$\frac{{c}^{2}(HI)}{c({H}_{2})×c({I}_{2})}$;
③该反应为体积不变的反应,压强不影响化学平衡,所以无法利用此反应研究压强对化学平衡的影响.
解答 解:(1)Ⅰ为参照实验,实验Ⅱ与Ⅰ中只有反应温度不同,其他条件相同,实验Ⅱ为探究温度对反应速率的影响;实验Ⅲ探究催化剂对反应速率的影响,所以实验Ⅲ与实验Ⅰ中除了催化剂不同外,其它条件完全相同,即温度应该为457℃,
故答案为:探究温度对该反应速率的影响;0;457;
(2)①根据图象可知,0-5min内碘单质的浓度变化为:△c(I2)=(9-4)mol/L=5×10-3mol/L,
在0~5min内反应的平均速率ν(I2)=v=$\frac{△c}{△t}$=$\frac{5×1{0}^{-3}mol•{L}^{-1}}{5min}$=1×10-3mol•L-1•min-1,
故答案为:1×10-3mol•L-1•min-1;
②根据反应H2(g)+I2(g)?2HI(g)可知,当达到化学平衡时,c(I2)=3×10-3mol/L,:△c(I2)=(9-3)×10-3mol/L=6×10-3mol/L,△c(H2)=6×10-3mol/L,c(H2)=(7-6)×10-3mol/L=1×10-3mol/L,c(HI)=2△c(I2)=12×10-3mol/L,平衡常数K=$\frac{{c}^{2}(HI)}{c({H}_{2})×c({I}_{2})}$=$\frac{(12×1{0}^{-3})^{2}}{(1×1{0}^{-3})×(3×1{0}^{-3})}$=48,
故答案为:$\frac{{c}^{2}(HI)}{c({H}_{2})×c({I}_{2})}$;48;
③由于该可逆反应中,反应方程式两边气体的体积不变,所以压强不影响化学平衡,不能利用此反应探究压强对化学平衡的影响,
故答案为:不能;该反应前后气体计量数相等,平衡不受压强的影响.
点评 本题考查了探究温度、催化剂对化学反应速率的影响,注意明确温度、压强、催化剂等化学反应速率的因素,其中化学反应速率、平衡常数的计算要仔细,提高准确性,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O3 | C. | NO2 | D. | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
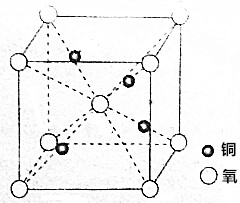 铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.
铜的一种氧化物在陶瓷涂色等方面有重要应用,它的晶胞如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都是常见的铁矿石 | |
| B. | 纤维素、PLA(聚乳酸)、维生素C、硝化纤维等都是高分子化合物 | |
| C. | 高容量的储氢材料的研制是推广应用燃料电池的关键问题之一 | |
| D. | 将呼吸产生的二氧化碳用石灰水吸收符合”低碳经济“原则 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试管1 | 试管2 | |
| 实验现象 | 褪色很快 | 褪色很慢 |
| 褪色时间/s | 4秒 | 31秒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,写出另一种盐的电子式
,写出另一种盐的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com