
| A.X﹥Z﹥Y﹥W | B.Z﹥W﹥X﹥Y |
| C.Z﹥Y﹥X﹥W | D.Z﹥X﹥Y﹥W |
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源:不详 题型:单选题
A.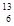 C C | B.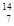 N N | C. P P | D.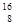 O O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在多电子的原子里,能量高的电子通常在离核近的区域内活动 |
| B.元素周期表中,在金属与非金属的分界线附近可以找到半导体材料 |
| C.含有离子键的化合物一定是离子化合物 |
| D.全部由非金属组成的化合物可能是离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④⑥⑦ | B.①②③ | C.③⑤⑥ | D.①⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性: HClO4 > HBrO4 > HIO4 | B.碱性: NaOH > Mg(OH)2 > Al(OH)3 |
| C.稳定性: PH3 > H2S > HCl | D.非金属性:F > O > S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:X>Y>Z | B.气态氢化物的稳定性HX>H2Y>ZH3 |
| C.非金属性:X>Y>Z | D.阴离子的还原性:Z3->Y2->X- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com