
| A. | 煤的干馏和石油的分馏都属化学变化 | |
| B. | 硫酸钡在医学上用作钡餐,钡离子对人体无害 | |
| C. | 碳-14可用作文物年代的鉴定,碳-14与碳-12互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
分析 A.物理变化和化学变化的区别是有无新物质生成;
B.钡盐是重金属盐,可溶性重金属盐有毒;
C.同位素的概念:同种元素的不同原子互称同位素;
D.胶体是指分散质粒子直径介于1nm到100nm之间的分散系.
解答 解:A.煤的干馏有新物质生成,故是化学变化,故A错误;
B.钡盐是重金属盐,可溶性重金属盐有毒.BaSO4 不溶于水不能电离出Ba2+,故是无毒的,能在医学上用作钡餐,而Ba2+对人体有毒,能引起蛋白质的变性,故B错误;
C.同位素的概念:同种元素的不同原子互称同位素;同素异形体是由同种元素形成的不同单质,故14C与12C互为同位素,故C错误;
D.胶体是指分散质粒子直径介于1nm到100nm之间的分散系,其特征性质是丁达尔效应.而葡萄糖注射液是溶液,不是胶体,故不能产生丁达尔效应,故D正确.
故选D.
点评 本题考查了石油的分馏和煤的干馏、同位素和同素异形体的概念的辨析以及重金属盐的性质,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
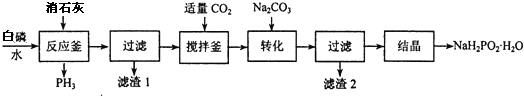
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品受损后,铁制品比受损前更容易生锈 | |
| B. | 其他条件不变时,降低温度可使铁与稀盐酸反应的速率增大 | |
| C. | T℃时,反应A(g)+3B(g)?2C(g)达平衡后时,A的生成速率与C的生成速率相等 | |
| D. | 在密闭容器中反应aA(g)?bB(g)达平衡后,保持温度不变,将容器容积增加一倍,当达到新平衡时,B的浓度是原来的60%,则a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
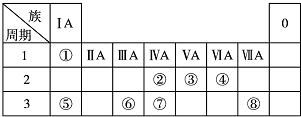
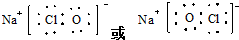 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |
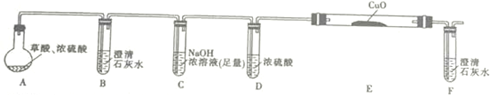
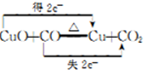 .
.| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
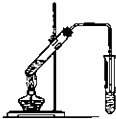 (1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.
(1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com