
下列说法正确的是
A.自发反应在任何条件下都能实现
B.化学反应不一定都有能量变化
C.升高温度,活化分子百分数增大,化学反应速率一定增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率
科目:高中化学 来源:2015-2016学年吉林省扶余市高一上学期期中测试化学试卷(解析版) 题型:选择题
在配制一定物质的量浓度的溶液的实验中,下列操作正确的是
A.欲配制1000mL 0.1mol·L-1的盐酸,将稀释后的盐酸溶液全部转移到未经干燥的1000mL的容量瓶中,加水至刻度线2cm时,再用胶头滴管加水至刻度线
B.将准确量取的18.4mol·L-1的硫酸10mL,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线,即可制得100mL稀硫酸
C.仰视容量瓶刻度线,看到液面超过了容量瓶的刻度线,用胶头滴管吸出刻度线以上的溶液
D.将氢氧化钠固体放在有滤纸的天平托盘上,精确称量并放入烧杯中溶解后,立即注入容量瓶中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北成安一中、永年二中高一上期中联考化学试卷(解析版) 题型:实验题
某同学设计如下实验方案,以分离NaCl和CaCl2两种固体混合物,试回答:
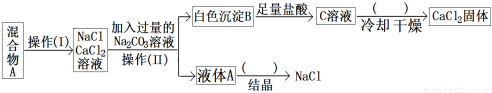
(1)操作I的名称是 ,操作II的名称是 。图中括号内的操作步骤均为 ;
(2)写出生成B的方程式为: 。
(3)按此实验方案得到的NaCl固体中肯定含有 (填化学式)杂质;为了解决这个问题可以向操作(II)得到的液体A中加入适量的 ;反应的方程式为:__________________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一上学期二次月考化学试卷(解析版) 题型:选择题
下列关于物质的量浓度表述正确的是
A.0.2mol·L-1Na2SO4溶液中含有Na+和SO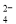 总物质的量为0.6mol
总物质的量为0.6mol
B.50mL2mol·L-1NaCl溶液和100mL0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢所得盐酸的浓度是1mol·L-1
D.10g98%的硫酸(密度为1.84g·cm-3)与10mL18.4mol·L-1的硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(理)化学试卷(解析版) 题型:填空题
用编号填空:
(1)下列关于燃烧热的说法正确的是
A.101kPa时1mol氢气完全燃烧生成水蒸气所放出的热量即氢气的燃烧热;
B.101kPa时1mol碳在氧气中燃烧生成CO所放出的热量即碳的燃烧热;
C.某物质的燃烧热不随热化学方程式计量数的改变而改变。
(2)下列关于用稀盐酸和氢氧化钠稀溶液测中和热的说法错误的是
A.实验结果随反应物用量改变而改变;
B.实验中氢氧化钠溶液稍过量是为了使盐酸完全被氢氧化钠中和;
C.实验中不可用环形铜质搅拌棒代替环形玻璃搅拌棒。
(3)下列关于化学平衡的说法错误的是
A.若改变影响化学平衡的条件之一,平衡向能够使这种改变减弱的方向移动;
B.达到化学平衡时,各组分的浓度不再改变,反应停止;
C.化学平衡移动,化学平衡常数不一定改变。
(4)改变下列条件,化学平衡一定向正反应方向移动的是
A.增大反应物浓度 B.升高温度 C.增大压强
(5)下列关于电解质的说法错误的是
A.酸、碱、盐及氧化物都是电解质;
B.电解质溶液能导电是因为发生了电离,产生了自由移动的离子;
C.电解质不一定能导电,能导电的物质不一定是电解质。
(6)下列反应的△H<0的是
A.铝和稀硫酸反应 B.碳酸氢铵受热分解 C.氢氧化钡晶体与氯化铵晶体反应
(7)下列情况,均为日常生活中为了改变反应速率而采取的措施,其中不属于浓度影响反应速率的是
A.汽车加大油门 B.食物放冰箱 C.糕点包装袋里放小包除氧剂
(8)下列实验现象与实际不符的是
A.向4mL0.01mol/LKMnO4酸性溶液中加入2mL0.1mol/LH2C2O4溶液:溶液褪色;
B.浓度均为0.1mol/L的Na2S2O3和H2SO4溶液等体积混合:溶液变浑浊;
C.将盛有NO2和N2O4混合气体的容器压缩:混合气体颜色比压缩前浅。
(9)一定温度下,有三种酸:A.盐酸,B.硫酸,C.醋酸,回答下列问题:
①三种酸溶液等物质的量浓度时,c(H+)最大的是 ;
②三种酸的c(H+)相同时,溶液浓度最大的是 ;
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,再加入同样的锌粒,反应最快的是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(文)化学试卷(解析版) 题型:选择题
鉴别织物成分是真丝还是人造丝,正确的操作方法是
A.滴加醋酸 B.滴加浓硫酸 C.滴加酒精 D.灼烧
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上学期期中理综化学试卷(解析版) 题型:填空题
一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g)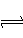 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。

(1)根据右图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
(3)该可逆反应达到化学平衡状态的标志是 (填字母)。
a、CO、H2、CH3OH的浓度均不再变化
b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变
d、v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容 积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a、c(H2)减少 b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加 d、重新平衡时c(H2)/ c(CH3OH)减小
(5)根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。

(6)以甲醇、空气、氢氧化钾溶液为原料, 石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:
石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:
2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为: 。
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三11月月考理科综合化学试卷(解析版) 题型:填空题
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com