
 ��ˮ�Ȼ������л��������ô����������Ϊ��ɫ���壬178��ʱ���������׳��⣬��ˮ��ᷢ�Ȳ�����������ʵ����������װ���Ʊ�������ˮ�Ȼ������䷴Ӧԭ��Ϊ��2Al+6HCl��g���T2AlCl3+3H2�����������գ�
��ˮ�Ȼ������л��������ô����������Ϊ��ɫ���壬178��ʱ���������׳��⣬��ˮ��ᷢ�Ȳ�����������ʵ����������װ���Ʊ�������ˮ�Ȼ������䷴Ӧԭ��Ϊ��2Al+6HCl��g���T2AlCl3+3H2�����������գ�| M[Al(OH)nCl(6-n)] |
| 2M(AlCl3) |
| ||
| ||
| M[Al(OH)nCl(6-n)] |
| 2M(AlCl3) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
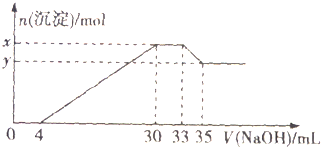
| A��ԭ��Һ��n��Mg2+����n��A13+��=10��1 |
| B��ԭ��Һ��c��H+��=0.8mol/L |
| C��x��y�IJ�ֵΪ0.08 |
| D��ԭ��Һ��c��C1-��=0.66mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaOHϡ��Һ�ֱ���ϡ�����ϡ���ᷴӦ����1 mol H2O���ų�������ͬ |
| B��ϡ����ֱ���NaOHϡ��Һ��ϡ��ˮ��Ӧ����1 mol H2O���ų�������ͬ |
| C��Ba��OH��2ϡ��Һ�ֱ���ϡ�����ϡ���ᷴӦ����1 mol H2O���ų�������ͬ |
| D���÷�Ӧ˵����ˮ���ɵķ�Ӧ�Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A������������ʵ���Ũ��Ϊ9.2mol?L-1 |
| B��1 mol Zn�������ĸ����ᷴӦ����2g���� |
| C��������������ˮ���������Һ�����ʵ���Ũ�ȵ���9.2mol?L-1 |
| D����50 mL��������Һ�м���������ͭƬ�����ȳ�ַ�Ӧ����ԭ����������ʵ���С��0.46 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 MPa | 2 MPa | 3 MPa | |
| 500�� | 45.3% | ||
| 700�� | a | 66.7% | |
| 900�� | 73.6% |
| A���÷�Ӧ�ġ�H��0 |
| B��45.3%��a��66.7% |
| C���÷�Ӧ��ƽ�ⳣ��K��900�棩��K��700�棩 |
| D��700�桢2 MPaʱR��ת����Ϊ50% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ �ⳣ�� | 1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | 3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ں��д���AlO2-����Һ�У�NH4+��Na+��Cl-��H+ |
| B����pH=12����Һ�У�NH4+��K+��ClO-��Cl- |
| C����NO3-���ڵ�ǿ������Һ�У�NH4+��Ba2+��Fe2+��Br- |
| D����̼�����Ƶ���Һ�У�K+��SO42-��Cl-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��5.05��10-4mol?L-1 |
| B��5.56��10-3mol?L-1 |
| C��1.01��10-4mol?L-1 |
| D��1.01��10-3mol?L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com