
| A. | 相同温度下,AgCl在水中的溶解度大于在氯化钠溶液中的溶解度 | |
| B. | 浓FeCl3溶液滴入沸水加热形成红褐色透明液体 | |
| C. | 自然界地表层原生铜矿变成CuSO4溶液向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS) | |
| D. | 加入少量AgCl固体可以除去氯化钠溶液中的少量硫化钠杂质 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,勒夏特列原理适用于所有的可逆反应,勒夏特列原理不适用于非可逆反应,据此分析解答.
解答 解:A、在氯化钠中,相当于在水中增加氯离子的量,AgCl的沉淀溶解平衡向逆向移动,溶解度减小,能用沉淀溶解平衡移动原理解释,故A不选;
B、浓FeCl3溶液滴入沸水加热形成红褐色透明液体是因为氯化铁和水之间发生水解反应,不能用沉淀溶解平衡移动原理解释,故B选;
C、原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,CuSO4与ZnS反应生成硫化铜和硫酸锌,最后生成溶解度更小的CuS,这些反应都是复分解反应,沉淀向着更难溶解的方向进行,能用沉淀溶解平衡移动原理解释,故C不选;
D、氯化银可以和硫化钠之间反应生成溶解度更小的硫化银,沉淀向着更难溶解的方向进行,能用沉淀溶解平衡移动原理解释,故D不选;
故选B.
点评 本题考查勒夏特里原在沉淀转化中的应用,侧重考查基本理论,明确勒夏特里原理适用范围即可解答,知道勒夏特里原理内涵,题目难度不大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
| 混合物 | 需加入的试剂 | 分离方法 |
| ①苯(苯酚) | ||
| ②乙烷(乙烯) | ||
| ③乙醇(水) | ||
| ④乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;W单质晶体中微粒堆积方式为面心立方堆积,若W单质晶体中一个晶胞的边长为a cm,则W单质晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g/cm3(写出含a的表 达式,用NA表示阿伏加德罗常数的值)g.cm-3.
;W单质晶体中微粒堆积方式为面心立方堆积,若W单质晶体中一个晶胞的边长为a cm,则W单质晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g/cm3(写出含a的表 达式,用NA表示阿伏加德罗常数的值)g.cm-3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥⑧⑩ | B. | ②③⑦⑧⑨ | C. | ②⑤⑨ | D. | ②⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、MnO4-、Cl- | B. | Cl-、SO32-、K+、Na+ | ||
| C. | Na+、Cl-、CH3COO-、K+ | D. | K+、I-、Na+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
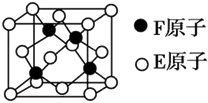 周期表中前四周期的六种元素A、B、C、D、E、F的原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D的单质晶体的熔点在同周期形成的单质中最高;F2+核外各亚层电子均已充满.
周期表中前四周期的六种元素A、B、C、D、E、F的原子序数依次增大,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D的单质晶体的熔点在同周期形成的单质中最高;F2+核外各亚层电子均已充满.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(苯酚):加浓溴水振荡,分液 | |
| B. | 亚硫酸钠溶液(硫酸钠):加入过量的氯化钡溶液、过滤 | |
| C. | 乙醇(乙酸):加氢氧化钠溶液,蒸馏 | |
| D. | 乙酸乙酯(乙酸):加氢氧化钠溶液,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清的石灰水或CaCl2溶液都可以鉴别Na2CO3和NaHCO3溶液 | |
| B. | 分别滴酚酞后的饱和Na2CO3溶液比饱和NaHCO3溶液的颜色深 | |
| C. | 氧化铝和氢氧化铝均能溶于氢氧化钠溶液,溶解后所得产物不同 | |
| D. | 等质量的Al分别与过量的NaOH、HCl溶液反应,NaOH溶液放出的H2多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com