
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为10 mL):
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时,探究温度对化学反应速率的影响,应选择__________(填实验编号);探究浓度对化学反应速率的影响,应选择__________(填实验编号);若同时选择①②③溶液测定变浑浊的时间,是探究__________对化学反应速率的影响。
(2)已知Na2S2O3溶液与Cl2反应时,1 mol Na2S2O3转移 8 mol 电子,该反应的离子方程式是________________________________________________________________________。
甲同学设计如下实验流程探究Na2S2O3的化学性质。
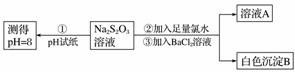
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和________性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是
________________________________________________________________________。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是________(填“甲”或“乙”),理由是_____________________________。
答案 (1)①⑤或②④ ①②或①③或④⑤ 改变不同反应物的浓度
(2)S2O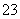 +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO +8Cl-+10H+
+8Cl-+10H+
(Ⅰ)还原 (Ⅱ)SO +Ba2+===BaSO4↓ (Ⅲ)乙 可以排除BaS2O3的干扰
+Ba2+===BaSO4↓ (Ⅲ)乙 可以排除BaS2O3的干扰
解析 (1)探究温度对反应速率的影响,应控制Na2S2O3、H2SO4的浓度相同,所以应选择①⑤或②④组;探究浓度对化学反应速率的影响,应控制温度相同,所以应选择①②或①③或④⑤;在①②③中,温度相同,改变的是不同反应物的浓度。
(2)由于S2O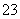 +4Cl2+5H2O===2SO
+4Cl2+5H2O===2SO +8Cl-+10H+,所以Na2S2O
+8Cl-+10H+,所以Na2S2O 具有还原性;由于其溶液pH=8,则证明S2O
具有还原性;由于其溶液pH=8,则证明S2O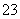 水解呈碱性;要证明S2O
水解呈碱性;要证明S2O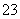 的还原性,应先加BaCl2溶液,再加足量氯水,这样可以排除BaS2O3的干扰。
的还原性,应先加BaCl2溶液,再加足量氯水,这样可以排除BaS2O3的干扰。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
A.X、Y、Z三种元素最低价氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关蛋白质的说法正确的是 ( )
A.氨基酸、淀粉均属于高分子化合物
B.蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N
C.若两种二肽互为同分异构体,则二者的水解产物一定不一致
D.用甘氨酸(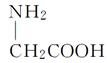 )和丙氨酸(
)和丙氨酸(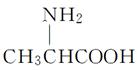 )缩合最多可形成四种二肽
)缩合最多可形成四种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某蛋白质的结构片段:
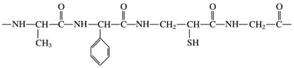
(1)上述蛋白质结构片段的水解产物中不属于α氨基酸的结构简式为________________________________________________________________________。
(2)上述蛋白质结构片段水解后的氨基酸中,某氨基酸碳氢原子数比值最大。
①该氨基酸与NaOH溶液反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
②该氨基酸两分子缩合形成环状结构物质的分子式为
________________________________________________________________________
________________________________________________________________________。
③该氨基酸的同分异构体中,属于硝基化合物且苯环上只有甲基的同分异构体有________种。
(3)已知上述蛋白质结构片段的相对分子质量为364,则水解生成的各种氨基酸的相对分子质量之和为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法探究影响化学反应速率的因素。
实验一:利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案,研究影响反应速率的因素。
(1)甲同学的实验报告如表所示:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取三份等体积的2 mol·L-1硫酸于试管中 ②分别投入大小、形状相同的Cu、Fe、Mg | 反应产生气泡的速率大小:Mg>Fe>Cu | 反应物的性质越活泼,反应速率越大 |
该同学的实验目的是__________________,要想得出正确的实验结论,还需要控制的实验条件是________________________________________________________________________。
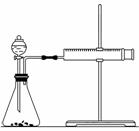
(2)乙同学为了能精确地研究浓度对反应速率的影响,在相同温度下利用如图所示装置进行定量实验。完成该实验应选用的实验药品是__________,应该测定的实验数据是____________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内反应速率较小,溶液褪色不明显,但反应一段时间后,溶液突然褪色,反应速率明显增大。
(3)针对上述实验现象,某同学认为该反应放热,导致溶液的温度升高,从而使反应速率增大。从影响化学反应速率的因素看,你认为还可能是________的影响。
(4)若要用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还可以在反应开始时加入________(填字母)。
A.硫酸钾 B.硫酸锰
C.氯化锰 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语表示正确的是( )
①甲基的电子式: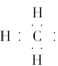
②乙炔的最简式:C2H2
③蔗糖的分子式:C12H22O11
④乙醛的结构简式:CH3COH
⑤苯分子的比例模型: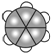
A.①②④ B.③⑤
C.②③⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。
(1)写出硅烷分子式通式________________________________;
(2)写出乙硅烷在空气中自燃的化学方程式:_________________________________________________________________________________________________________________________________;
(3)相同状况下,甲硅烷的密度________(填“大于”“小于”或“等于”)甲烷;
(4)甲硅烷的热稳定性________(填“大于”“小于”或“等于”)甲烷。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)过氧化钠的电子式: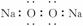 (×)
(×)
(2014·江苏,2A)
(2)氢氧根离子的电子式: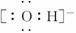 (√)
(√)
(2013·江苏,2B)
(3)NH4Br的电子式: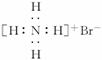 (×)
(×)
(2012·海南,9A)
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒压下,在一个容积可变的密闭容器中发生反应:A(g)+B(g)C(g),若开始时通入1 mol A和1 mol B,达到平衡时生成a mol C。则下列说法错误的是( )
A.若开始时通入3 mol A和3 mol B,达到平衡时,生成的C的物质的量为3a mol
B.若开始时通入4 mol A、4 mol B和2 mol C,达到平衡时,B的物质的量一定大于4 mol
C.若开始时通入2 mol A、2 mol B和1 mol C,达到平衡时,再通入3 mol C,则再次达到平衡后,C的物质的量分数为
D.若在原平衡体系中,再通入1 mol A和1 mol B,混合气体的平均相对分子质量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com