
25℃、101 kPa条件下,反应2N2Q(g)=4NO2(g)+O2(g) △H=+56.7 kJ·mol-1能自发进行的原因 ( )
A.是吸热反应 B.是放热反应
C.是熵减小的反应 D.是熵增效应大于热效应
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
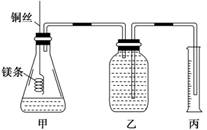 |
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用 (填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少
为 ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法: 。
(2)实验步骤⑤中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意 。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ,若未除去镁条表面的氧化膜,则测量结果 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2010年高三备考“好题速递”系列(20) 题型:实验题
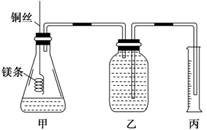 |
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用 (填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少
为 ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法: 。
(2)实验步骤⑤中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意 。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ,若未除去镁条表面的氧化膜,则测量结果 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的化工原料和液体燃料,可以利用下列反
应制取乙醇:
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是________________________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
|
| 500 | 600 | 700 | 800 | ||
| 1.5 | 45 | 33 | 20 | 12 | ||
| 2.0 | 60 | 43 | 28 | 15 | ||
| 3.0 | 83 | 62 | 37 | 22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________;平衡常数K______________。(填“增大”、“减小”、或“不变”)
 (4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
(4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
影响,并对图中横坐标、纵坐标的含义作必要的标注。
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇
与氧作用生成水和二氧化碳。该电池的负极反应式为:
___________________________________________________。
(6)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:天津市南开区2010届高三第一次模拟考试 题型:填空题
乙醇是重要的化工原料和液体燃料,可以利用下列反
应制取乙醇:
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)
(1)写出该反应的平衡常数表达式:K=_________________________。
(2)请说明以CO2为原料合成乙醇的优点是________________________________(只要求写出一条)。
(3)在一定压强下,测得该反应的实验数据如下表:
|
|
500 |
600 |
700 |
800 |
||
|
1.5 |
45 |
33 |
20 |
12 |
||
|
2.0 |
60 |
43 |
28 |
15 |
||
|
3.0 |
83 |
62 |
37 |
22 |
① 该反应是___________反应(填“吸热”或“放热”)。
② 一定条件下,若提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______________;平衡常数K______________。(填“增大”、“减小”、或“不变”)
 (4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
(4)在右图的坐标系中作图说明压强变化对该反应化学平衡的
影响,并对图中横坐标、纵坐标的含义作必要的标注。
(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇
与氧作用生成水和二氧化碳。该电池的负极反应式为:
___________________________________________________。
(6)25℃、101 kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8 kJ · mol-1、1411.0 kJ · mol-1和1366.8 kJ · mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com