
����Ŀ��(1) д����ԭ�ӵĵ����Ų�ʽ_____________��
(2) ��ͪ(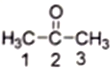 )������2��̼ԭ�ӵ��ӻ���ʽΪ__________����CS2��Ϊ�ȵ��������������__________(дһ��)��
)������2��̼ԭ�ӵ��ӻ���ʽΪ__________����CS2��Ϊ�ȵ��������������__________(дһ��)��
(3)��0.1mol[Cr(H2O)Cl]Cl2��H2O��ˮ��Һ��������������Һ��Ӧ����_______molAgCl������H2O���ӵļ��DZ�H2S���ӵļ��Ǵ�ԭ����_______ ��
(4) ��ͭ�����γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ(�ڵ����ͭԭ��)��

���þ���Ļ�ѧʽΪ_______��
���������ڵ�4���ڵ���������γɵ����幹����_______��
�۾�������һ����ԭ�Ӿ����������ԭ����_______����
����֪�þ�����ܶ�Ϊ��g.cm-3�������ӵ�������ֵΪNA����þ�����ͭԭ�Ӻ���ԭ��֮�����̾���Ϊ_______pm(�г�����ʽ����)��
���𰸡� 1s22s22p63s23p63d84s2 ��[Ar]3d84s2 sp2�ӻ� SCN������OCN����CNO����N3-�ȣ� 0.2 ����ԭ�Ӱ뾶����С���縺�Ա������ˮ�����гɼ����ӶԸ���������ԭ�ӣ���ų����ô��Ǵ� CuCl ���������� 12 ![]() ��
��![]() ��1010
��1010
����������1������28��Ԫ�أ���ԭ�Ӻ�����28�����ӣ�����ԭ�Ӻ�������Ų����ɿɵ���ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s23p63d84s2 ��[Ar]3d84s2��
��2����ͪ(CH3COCH3)�ʻ��е�̼ԭ���γ���3���������¶Ե��ӣ�����Ϊsp2�ӻ���SCN-��OCN-��CNO-��N3-����CS2ԭ�Ӹ�����ͬ���۵�������ͬ����Ϊ�ȵ�������
��3��[Cr(H2O)Cl]Cl2��H2O�й�����3�������ӣ�����1������������ԭ�ӣ���2�������ӿ���Ag+��ϳ�AgCl���������Ժ�0.1mol[Cr(H2O)Cl]Cl2��H2O��ˮ��Һ��������������Һ��Ӧ����0.2molAgCl������H2O������H2S�������е�O��Sԭ�Ӷ���ȡ��sp3�ӻ�������2���µ��Ӷԣ�������ԭ�Ӱ뾶�����С���縺�Ա����ˮ�����гɼ����ӶԸ���������ԭ�ӣ���ų����ô��Ǵ���
��4���ٸþ���Ϊ��������������ԭ��ռ![]() ������ԭ��ռ
������ԭ��ռ![]() ���ڲ�ԭ��Ϊ�����������У����Ըþ����У�Clԭ�ӵ���ĿΪ��8��
���ڲ�ԭ��Ϊ�����������У����Ըþ����У�Clԭ�ӵ���ĿΪ��8��![]() +6��
+6��![]() =4��Cuԭ�ӵ���ĿΪ4����þ���Ļ�ѧʽΪCuCl�����ɾ����ṹ���Կ������þ�������ʯ�������ƣ����Խ������ڵ��ĸ��ڵ�����ӣ��������һ�����������������Ծ�������Clԭ��Ϊ�о�������8���������ø�Clԭ�ӣ�ÿ��Clԭ��������ĵ�Clԭ�Ӿ��������ÿ������Clԭ��Ϊ�����������ã�����ÿ����ԭ����Χ��֮�����������ԭ�Ӹ���Ϊ��3��8��
=4��Cuԭ�ӵ���ĿΪ4����þ���Ļ�ѧʽΪCuCl�����ɾ����ṹ���Կ������þ�������ʯ�������ƣ����Խ������ڵ��ĸ��ڵ�����ӣ��������һ�����������������Ծ�������Clԭ��Ϊ�о�������8���������ø�Clԭ�ӣ�ÿ��Clԭ��������ĵ�Clԭ�Ӿ��������ÿ������Clԭ��Ϊ�����������ã�����ÿ����ԭ����Χ��֮�����������ԭ�Ӹ���Ϊ��3��8��![]() =12�����辧���߳�Ϊacm����һ�����������Ϊa3cm3��һ�������к���4��Cuԭ�Ӻ�4��Clԭ�ӣ���1������������Ϊm=
=12�����辧���߳�Ϊacm����һ�����������Ϊa3cm3��һ�������к���4��Cuԭ�Ӻ�4��Clԭ�ӣ���1������������Ϊm=![]() g=
g=![]() g����Ϊ�ܶ�Ϊ��g.cm-3�����Ծ����ı߳�a=
g����Ϊ�ܶ�Ϊ��g.cm-3�����Ծ����ı߳�a=![]() cm��CuCl�ľ�������ʯ�������ƣ����Ըþ�����ͭԭ�Ӻ���ԭ��֮�����̾���Ϊ
cm��CuCl�ľ�������ʯ�������ƣ����Ըþ�����ͭԭ�Ӻ���ԭ��֮�����̾���Ϊ![]() ��
��![]() cm=
cm=![]() ��
��![]() ��101pm��
��101pm��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����������й�����Ũ��֮��Ĺ�ϵ�������
A. ��0.2mol/L NaHCO3��Һ��0.1mol/L KOH��Һ��������:3c(K+) +c(H+)=c(OH-) +c(HCO3-) +2c(CO32-)
B. Ũ�Ⱦ�Ϊ0.1mol/L ��CH3COOH ��CH3COONa��Һ�������Ϻ�pH=5,������Һ��:c(CH3COO-)-c(CH3COOH)=2��(10-5-10-9) mol/L
C. ��CO2ͨ��0.1mol/L Na2CO3��Һ�����ԣ���Һ��2c (CO32-) + c (HCO3-)=0.1mol/L
D. Ka(CH3COOH)=Kb(NH3��H2O) =1.8��10-5��������0.1mol/L CH3COONH4��c(CH3COO-):c(NH3��H2O)=180
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��һ�������£�ƽ�ⳣ��������
2NO2![]() N2O4 K1 NO2
N2O4 K1 NO2![]() 1/2N2O4K2 N2O4
1/2N2O4K2 N2O4![]() 2NO2 K3
2NO2 K3
�Ƶ�K1��K2,K1��K3�Ĺ�ϵ�ֱ�Ϊ:______________��
��2����������������ָ����:���ԡ�ѡ���ԡ��ȶ��ԡ��۸�ȡ����ڸ��������·�Ӧ��֮���ܹ�ͬʱ���������Ӧ�����,����Ĵ������Դ�������Ŀ����������ղ����е�____(����������������������ת����)���������������ԣ���������________�ԡ�
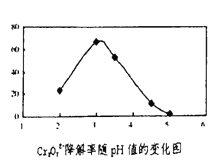
��3����Һ��pH��Cr2O72-�����ʵ�Ӱ������ͼ��ʾ��
��֪:Cu2O![]() Cu+CuSO4��
Cu+CuSO4��
����Խ��Cr2O72-����ԭ��Խ��
��������ͼ��֪��pH�ֱ�Ϊ2��3��4 ʱ��Cr2O72-�Ľ�������õ���______����ԭ����______��
�ڰ���ͼ����10��Ũ���ᣬ��Һ�ɳȻ�ɫ��Ϊ��ɫ�����ϻ�ѧ������ƽ���ƶ�ԭ��������ԭ��_____��
��4��һ�������½�̿���Ի�ԭNO2,��ӦΪ:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)���ں��µ��ܱ������£�6molNO2������C �����÷�Ӧ�����ƽ��ʱNO2�����ʵ�����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ:
N2(g)+2CO2(g)���ں��µ��ܱ������£�6molNO2������C �����÷�Ӧ�����ƽ��ʱNO2�����ʵ�����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ:
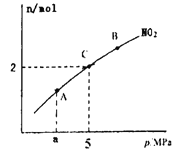
��C��NO2��ת���ʺ�C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp=(K,����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)�ֱ�Ϊ______��_______��
��5����֪��CO����CO2�Ļ�ѧ����ʽΪCO+O2![]() CO2+O��������Ӧ����Ϊv��=K��c(CO)��c(O2),�淴Ӧ����Ϊv��=K��c(CO2)��c(O),K����K��Ϊ���ʳ�������2500K�£�K��=1.21��105 L��s-1��mol-1,K��=3.02��105L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ_______(����С�����һλС��)��
CO2+O��������Ӧ����Ϊv��=K��c(CO)��c(O2),�淴Ӧ����Ϊv��=K��c(CO2)��c(O),K����K��Ϊ���ʳ�������2500K�£�K��=1.21��105 L��s-1��mol-1,K��=3.02��105L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ_______(����С�����һλС��)��
��6������ˮú���ϳɶ����ѵ�������Ӧ����:
��2H2(g) + CO(g) ![]() CH3OH(g); ��H1
CH3OH(g); ��H1
��CH3OH(g) ![]() CH2OCH3(g) + H2O(g); ��H2
CH2OCH3(g) + H2O(g); ��H2
��CO(g) + H2O(g) ![]() CO2(g) + H2(g); ��H3
CO2(g) + H2(g); ��H3
�ܷ�Ӧ: 3H2(g)+3CO(g) ![]() CH2OCH3(g)+CO2(g)����H=_______��
CH2OCH3(g)+CO2(g)����H=_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.������ռ��ۻ�ʱ�˷��Ļ�ѧ��������ͬ
B.�⾧������ת��ɵ����������յ��������ڿ˷���ԭ�Ӽ��������
C.SO3����ˮ�Ĺ������й��ۼ��Ķ��Ѻ����Ӽ����γ�
D.HF�����ȶ��Ժܺã���Ҫ����ΪHF���Ӽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100mL 0.1mol/L������50mL 0.2mol/L ��ˮ��ϣ���������Һ�У� ��
A. c(Cl-)>c(NH4+)> c(OH-)> c(H+) B. c(Cl-)=c(NH4+)> c(OH-)= c(H+)
C. c(H+)+c(Cl-)=c(NH4+)+ c(OH-)+2c(NH3.H2O) D. c(H+)+ c(NH4+)=c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2 L�����ܱ������г���1.0 mol A��1.0 mol B��������Ӧ��A(g)��B(g) ![]() C(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����( )
C(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ����( )
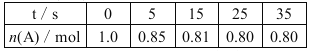
A����Ӧ��ǰ5 s��ƽ������v(A)��0.03 mol��L-1��s-1
B���ﵽƽ��ʱ��B��ת����Ϊ80��
C����ͬ�¶��£�����ʼʱ�������г���2.0 mol C����ﵽƽ��ʱC��Ũ��С��0.2 mol��L-1
D����ͬ�¶��£���ʼʱ�������г���0.20 mol A��0.20 mol B��1.0 mol C����Ӧ�ﵽƽ��ǰv(��)<v(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��CH4�dz��õ�ȼ�ϣ�����ÿ1mol�ֱ���ȫȼ������CO2��g����H2O��l��ʱ���ų��������ֱ�Ϊ393.5kJ��890.3kJ������˵������д����Ҫ������˵������Ҫ���㲽�裬ֻд�����𰸵IJ��ܵ÷֣�����ֵ������⣬��ֵ���������С�����1λ����
��1��1g C��ȫȼ��ʱ�ų���������
��2����ȫȼ����ͬ������C��CH4 �� ����ȼ�Ϸų������϶ࣿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ţ�̺ͽ�֭��ϣ���ţ�����̱��Ϊһ�ָ��й㶫��ɫ����Ʒ������ײ�̡�Ϊ������ţ�����������������ijͬѧ�ڲ�ͬ�¶ȵĵ���ţ���л���һЩ���ʽ�֭���۲�����15min�������Ƿ�����̣�������±�����ش��������⣺
�¶ȣ����� | 20 | 40 | 60 | 80 | 100 |
��� | 15min����δ�����̼��� | 14min����ȫ���� | 1min����ȫ���� | 1min����ȫ���� | 15min����δ�����̼��� |
��ע��������еĽ�֭�ظ�����ʵ�飬ţ�����κ��¶��¾��������̣�
��1��ʵ��֤�����ʽ�֭�к���һ��ø����������__��
��2��20����100��ʱ��15min����δ�����̼���˵��ø�Ļ��Խϵͣ���ԭ��ֱ���__��__��
��3����60��ʱţ�����н�֭��û�н�֭������¶��������̣�����Ӧ���е�tʱ�������м��˽�֭����ͼ��ͼ������ȷ��ʾ�ӽ�֭��ţ��������ʱ��仯���Ƶ�������__��
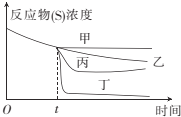
��4��Ϊ���ʵ���ȷ�ȣ�ʵ��������ͬ�¶ȵĵ���ţ���л���һЩ���ʽ�֭��������Ӧע�����__��
��5����ͬѧ˵����ʵ�鲻�ܵó���֭ʹţ�����̵������¶ȣ���������������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ���У�������Һ���Լ������ữ�������Լ�ѡ����ữ������ȷ���ǣ� ��
A.���Լ���SO ![]() ����BaCl2��Һ��HNO3�ữ
����BaCl2��Һ��HNO3�ữ
B.Ϊ�����KMnO4��Һ�����������������Ὣ���ữ
C.����ij��Һ���Ƿ�Cl�� �� ��HNO3�ữ��AgNO3��Һ
D.����FeCl2��Һʱͨ��������HNO3�ữ���Ա��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com