
| A. | 标况下,1 mol水分子占有的体积为 22.4L | |
| B. | 17g OH-中质子总数比电子总数多 NA | |
| C. | 物质的量浓度为 0.5mol/L的 MgCl2溶液中,含有 Cl-的数目为 NA | |
| D. | 4g氦气中所含氦原子的数目为 NA |
分析 A、气体摩尔体积22.4L/mol使用范围是气体;
B.一个氢氧根离子中质子数9,电子数为10,依据n=$\frac{m}{M}$计算物质的量分析质子数和电子数大小;
C.溶液体积不知不能计算微粒数;
D.氦气为单原子分子.
解答 解:A、标准状况下,水是液态,不是气体,不能使用气体摩尔体积,故A错误;
B.一个氢氧根离子中质子数9,电子数为10,依据n=$\frac{m}{M}$计算物质的量=$\frac{17g}{17g/mol}$=1mol,1mol氢氧根离子中含质子数9NA,电子数10NA,质子总数比电子总数小NA,故B错误;
C.物质的量浓度为 0.5mol/L的 MgCl2溶液中,含有 Cl-的浓度为1mol/L,溶液体积不知不能计算微粒数目,故C错误;
D.4g氦气物质的量=$\frac{4g}{4g/mol}$=1mol,1mol氦气中所含氦原子的数目为 NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析、气体摩尔体积条件应用,主要是物质的量和微粒数的计算关系,掌握基础是解题关键,题目难度中等.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | Y元素在元素周期表中的位置是第2周期第V族 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol任何气体的体积都约是22.4L | |
| B. | 标准状况下,气体的摩尔体积约是22.4L | |
| C. | 0℃,101kpa时,2gH2的体积约是22.4L | |
| D. | 标准状况下,1mol水的体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 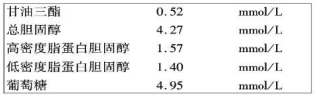 如图是一张体检血液化验单,化验单表示该体检指标的物理量是物质的量 | |
| B. | 水和四氯化碳可以用分液漏斗分离 | |
| C. | 烧杯、试管、蒸发皿、圆底烧瓶、蒸馏烧瓶都可用酒精灯加热 | |
| D. | 98%的浓硫酸,密度为 1.84g/mL,其物质的量浓度为 18.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作、现象 | 解释或结论 |
| A | 向饱和Na2CO3溶液中通入少量CO2无浑浊出现 | 生成NaHCO3量少未使溶液饱和 |
| B | 用NaOH标准溶液滴定未知浓度盐酸,滴定终点时俯视读数 | 测定盐酸浓度偏低 |
| C | 向氯化钡溶液通入过量SO2无明显现象,再①通氯气②通氨气,两种操作均会产生白色沉淀 | 白色沉淀①为硫酸钡,②为亚硫酸钡 |
| D | 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | Na+、K+、ClOˉ、SO42ˉ | 少量SO2 | 2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
| B | NH4+、Fe3+、Brˉ、SO42ˉ | 过量H2S | 2Fe3++H2S=2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | Cu+2Fe3+═2Fe2++Cu2+ |
| D | Na+、K+、HCO3-、AlO2- | 少量HCl | H++AlO2-+H20═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18 g•mol-1 | |
| B. | CH4的摩尔质量为16 g | |
| C. | 3.01×1023个SO2分子的质量为32 g | |
| D. | 1 mol NaCl溶于1 L水中,形成1 mol•L-1NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com