
 pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:单选题
 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是 | A.单位时间内生成nmolA2同时生成nmolAB |
| B.容器内的总物质的量不随时间变化 |
| C.单位时间内生成2nmolAB的同时生成nmolB2 |
| D.单位时间内生成nmolA2的同时生成nmolB2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4△H=—56.9kJ/mol下列分析不正确的是
N2O4△H=—56.9kJ/mol下列分析不正确的是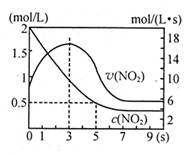
| A.5s时NO2的转化率为75% |
| B.0—3s时v(NO2)增大是由于体系温度升高 |
| C.3s时化学反应处于平衡状态 |
| D.9s时再充入N2O4,平衡后K较第一次平衡时大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是| A.该条件下反应的平衡常数为1.6×103 |
| B.通常情况下,该反应一定能自发进行 |
| C.题给条件下,O2的转化率是20% |
| D.当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
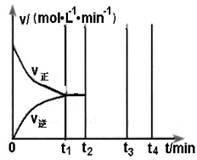
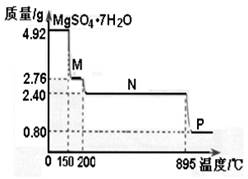
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
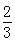 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com