
·ÖĪö £Ø1£©¶žŃõ»ÆµŖŗĶĖ®·“Ӧɜ³ÉĻõĖįŗĶŅ»Ńõ»ÆµŖ£»
£Ø2£©ĄūÓĆøĒĖ¹¶ØĀɽ«·½³ĢŹ½¢Ł”Į2-¢ŚµĆČČ»Æѧ·½³ĢŹ½£»
£Ø3£©øł¾ŻøĒĖ¹¶ØĀÉĒó³ö4CO£Øg£©+2NO2£Øg£©=N2£Øg£©+4CO2£Øg£©µÄ·“Ó¦ČČ£¬·“Ó¦ÖŠ3.36LCO¼“0.15mol×ŖŅĘ0.3molµē×Ó£¬øł¾ŻĪļÖŹµÄĮæÖ®±ČµČÓŚČČĮæ±ČĒó³ö·Å³öµÄČČĮ棻
£Ø4£©½«·½³ĢŹ½¢Ł+¢ŚµĆ2CH4£Øg£©+4NO2£Øg£©=2N2£Øg£©+2CO2£Øg£©+4H2O£Øg£©”÷H=”÷H1+”÷H2£¬½įŗĻ1molCH4»¹ŌNO2ÖĮN2µÄÕūøö¹ż³ĢÖŠ·Å³öµÄČČĮæĪŖ867kJ¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©¶žŃõ»ÆµŖŗĶĖ®·“Ӧɜ³ÉĻõĖįŗĶŅ»Ńõ»ÆµŖ£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ3NO2+H2O=2HNO3+NO£¬
¹Ź“š°øĪŖ£ŗ3NO2+H2O=2HNO3+NO£»
£Ø2£©¢ŁCO£Øg£©+$\frac{1}{2}$O2£Øg£©=CO2£Øg£©”÷H=-283.0kJ•mol-1
¢ŚS£Øs£©+O2£Øg£©=SO2£Øg£©”÷H=-296.0kJ•mol-1
½«·½³ĢŹ½¢Ł”Į2-¢ŚµĆ2CO£Øg£©+SO2£Øg£©=S£Øs£©+2CO2£Øg£©”÷H1=£Ø-283.0KJ•mol-1£©”Į2-£Ø-296.0KJ•mol-1£©=-270kJ•mol-1£¬
ĖłŅŌĘäČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗ2CO£Øg£©+SO2£Øg£©=S£Øs£©+2CO2£Øg£©”÷H1=-270kJ•mol-1£¬
¹Ź“š°øĪŖ£ŗ2CO£Øg£©+SO2£Øg£©=S£Øs£©+2CO2£Øg£©”÷H1=-270kJ•mol-1£»
£Ø3£©¢ŁCO£Øg£©+NO2£Øg£©=NO£Øg£©+CO2£Øg£©”÷H=-a kJ•mol-1£Øa£¾0£©
¢Ś2CO£Øg£©+2NO £Øg£©=N2£Øg£©+2CO2£Øg£©”÷H=-b kJ•mol-1£Øb£¾0£©
½«·½³ĢŹ½¢Ł”Į2+¢ŚµĆ4CO£Øg£©+2NO2£Øg£©=N2£Øg£©+4CO2£Øg£©”÷H=£Ø-a£© KJ•mol-1”Į2+£Ø-b KJ•mol-1£©=-£Ø2a+b£©kJ•mol-1
ĖłŅŌĘäČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ£ŗ4CO£Øg£©+2NO2£Øg£©=N2£Øg£©+4CO2£Øg£©”÷H=-£Ø2a+b£©kJ•mol-1£¬
øł¾Ż·½³ĢŹ½ÖŖ×ŖŅʵē×ÓµÄĪļÖŹµÄĮæĪŖ$\frac{3.36L}{22.4L/mol}$”Į2=0.3mol£¬µē×ÓŹżÄæĪŖ0.3NA£¬·Å³öµÄČČĮæĪŖ$\frac{3.36L}{22.4L/mol}$”Į$\frac{2a+b}{4}$kJ•mol-1=$\frac{3£Ø2a+b£©}{80}$kJ£¬
¹Ź“š°øĪŖ£ŗ0.3NA£¬$\frac{3£Ø2a+b£©}{80}$£»
£Ø4£©¢ŁCH4£Øg£©+4NO2£Øg£©=4NO£Øg£©+CO2£Øg£©+2H2O£Øg£©”÷H1=-574kJ•mol-1
¢ŚCH4£Øg£©+4NO£Øg£©=2N2£Øg£©+CO2£Øg£©+2H2O£Øg£©”÷H2=£æ
½«·½³ĢŹ½¢Ł+¢ŚµĆ2CH4£Øg£©+4NO2£Øg£©=2N2£Øg£©+2CO2£Øg£©+4H2O£Øg£©”÷H=”÷H1+”÷H2£¬
øł¾Ż·½³ĢŹ½ÖŖ£¬1mol CH4»¹ŌNO2ÖĮN2Õūøö¹ż³ĢÖŠ·Å³öµÄČČĮæĪŖ867kJ£¬ĖłŅŌ”÷H2=-867kJ/mol”Į2-£Ø-574kJ/mol£©=-1160kJ/mol£¬
¹Ź“š°øĪŖ£ŗ-1160kJ/mol£®
µćĘĄ ±¾Ģāæ¼²éĮĖøĒĖ¹¶ØĀɵÄÓŠ¹Ų¼ĘĖć£¬Éę¼°»Æѧ·“Ó¦·½³ĢŹ½”¢ČČ»Æѧ·“Ó¦·½³ĢŹ½µÄŹéŠ“µČÖŖŹ¶µć£¬»įĄūÓĆøĒĖ¹¶ØĀɏ銓³ö·“Ó¦ĪļÖ®¼äµÄ¹ŲĻµŹ½ŹĒ½ā±¾Ģā¹Ų¼ü£¬ÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗćĪĀĖõŠ”Ģå»ż£¬Ę½ŗāĻņÓŅŅĘ¶Æ£¬ŌŁ“Ī“ļĘ½ŗāŹ±ŃÕÉ«±ČŌĘ½ŗāĒ³ | |
| B£® | ŗćČŻÉżĪĀ£¬Äę·“Ó¦ĖŁĀŹ¼Óæģ£¬Õż·“Ó¦ĖŁĀŹ¼õĀż | |
| C£® | ČōøıäĢõ¼žŹ¹Ę½ŗāĻņÓŅŅĘ¶Æ£¬ŌņøĆ·“Ó¦µÄĘ½ŗā³£Źż½«Ōö“ó | |
| D£® | ŗćĪĀŗćČŻ£¬³äČėÉŁĮæNO2£¬ŌŁ“Ī“ļĘ½ŗāŹ±NO2µÄ×Ŗ»ÆĀŹ±ČŌĘ½ŗāµÄ“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ņµ„Ąė×ӵİė¾¶£ŗd£¾c | |
| B£® | µ„ÖŹµÄ·Šµć£ŗa£¼b | |
| C£® | b”¢dµÄŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļ¾łĪŖĒæĖį | |
| D£® | b”¢cæÉŠĪ³ÉĄė×Ó»ÆŗĻĪļb3c2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ŹĀŹµ | ½įĀŪ»ņĶĘ²ā | |
| A | NaÓėĄäĖ®¼¤ĮŅ·“Ó¦£¬Éś³ÉH2 | MgÓė·ŠĖ®ŃøĖŁ·“Ó¦£¬Éś³ÉH2 |
| B | F2ÓėH2°µ“¦¾ēĮŅ»ÆŗĻ£¬Éś³ÉµÄHFŗÜĪČ¶Ø | I2ÓėH2¼ÓČČŅ²ÄÜ»ÆŗĻ£¬Éś³ÉµÄHIŅ²ŗÜĪČ¶Ø |
| C | NaÓėO2¼ÓČČ·“Ӧɜ³ÉNa2O2 | IAŌŖĖŲµ„ÖŹÓėO2¼ÓČČ·“Ó¦¾łÉś³É¹żŃõ»ÆĪļ |
| D | H3PO4ŹĒÖŠĒæĖį£¬AsŹĒPµÄĶ¬Ö÷×å·Ē½šŹōŌŖĖŲ | H3AsO4ŹĒĒæĖį |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Č”ÓĆ·Ūĩד¹ĢĢå»ņ¹ĢĢ劔æÅĮ£Ź±£¬Ó¦ÓĆŅ©³×»ņÖ½²Ū£¬Č”ÓĆæéד¹ĢĢåŹ±£¬Ó¦ÓĆÄ÷×Ó¼ŠČ” | |
| B£® | Č”ÓĆĻøæŚĘæĄļµÄŹŌŅŗŹ±£¬ĻČÄĆĻĀĘæČū£¬µ¹·ÅŌŚ×ĄÉĻ£¬Č»ŗó±źĒ©³ÆĶāÄĆĘšĘæ×Ó£¬ĘææŚŅŖ½ō°¤×ÅŹŌ¹ÜæŚ£¬½«ŅŗĢå»ŗ»ŗµŲµ¹ČėŹŌ¹Ü | |
| C£® | ½ŗĶ·µĪ¹ÜČ”ĶźŅ»ÖÖŹŌŅŗŗó£¬æÉÖ±½ÓČ”ĮķŅ»ÖÖ²»ÓėĘä·“Ó¦µÄŹŌŅŗ | |
| D£® | µ±Ä³ŹµŃéĆ»ÓŠ×¼Č·µÄŅ©Ę·ÓĆĮæĖµĆ÷Ź±£¬ĪŖ擵½Ć÷ĻŌĻÖĻó£¬Č”ÓĆŅ©Ę·Ō½¶ąŌ½ŗĆ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
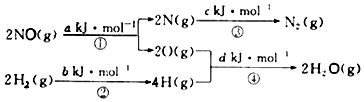
| A£® | 0.5£Øa+b-c-d£©kJ/mol | B£® | 0.5£Øc+a-d-b£©kJ/mol | ||
| C£® | 0.5£Øc+d-a-b£©kJ/mol | D£® | 0.5£Øc+d-a-b£©kJ/mol |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com