
高铁酸钾(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3 +3KClO+4KOH=2K2FeO4+3KCl+5H2O ,下列说法正确的是
A.制高铁酸钾用 KClO做还原剂
B.KCl是还原产物
C.高铁酸钾中铁的化合价为 +7
D.制备高铁酸钾时1 molFe(OH)3得到3 mol电子
科目:高中化学 来源:2016届福建省宁德市高一上学期期末考试化学试卷(A)(解析版) 题型:选择题
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应类型属于阴影部分的是
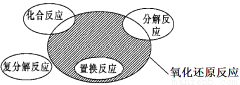
A.2Na2O2+2H2O=4NaOH+O2↑
B.NH4HCO3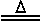 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.Br2+2KI=I2+2KBr
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高一上学期期末质量检测模拟化学试卷(解析版) 题型:选择题
下列与氮循环无关的生态环境问题是( )
A.光化学烟雾 B.白色污染 C.水体富营养化 D.酸雨
查看答案和解析>>
科目:高中化学 来源:2016届福建省高一上学期期中考试化学试卷(解析版) 题型:选择题
在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中, 是氧化剂; 是氧化产物;被还原的HNO3与参加反应的HNO3物质的量之比是 ;当有8mol HNO3被还原时,反应转移 个电子。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高一上学期期中考试化学试卷(解析版) 题型:选择题
某实验室合成了一种可溶的金属氯化物(RClx),为了测定该金属氯化物的成分,研究人员做了以下实验:取物质的量浓度为0.05 mol·L-1的金属氯化物(RClx) 溶液20 mL,使之恰好与20 mL 0.15 mol·L-1的AgNO3溶液完全反应。则该氯化物的化学式为
A.RCl B.RCl2 C.RCl3 D.RCl4
查看答案和解析>>
科目:高中化学 来源:2016届福建省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列关于新制氯水及久置氯水的说法,不正确的是
A.新制的氯水呈黄绿色,久置的氯水无色
B.新制的氯水漂白作用强,而久置的氯水漂白作用很弱
C.新制的氯水所含成分的种类多,而久置的氯水所含成分的种类较少
D.新制的氯水中无氯离子,而久置的氯水中则含氯离子
查看答案和解析>>
科目:高中化学 来源:2016届福建省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.直径介于1~100 nm之间的微粒称为胶体
B.聚沉现象可以证明胶体属于电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜
查看答案和解析>>
科目:高中化学 来源:2016届福建省南平市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列有关NaHCO3与Na2CO3的性质说法中,正确的是
A.往两者饱和溶液中通入CO2,最终会形成澄清溶液的是NaHCO3
B.除去碳酸氢钠固体中混有的少量碳酸钠可以采用加热的方法
C.碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠
D.二者配成溶液,再加入石灰水,无白色沉淀生成的是NaHCO3
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省嘉峪关市高一上学期期中考试化学试卷(解析版) 题型:实验题
用密度为1.84g/cm3,质量分数为98%的浓硫酸配制100mL 1.00mol/L 的稀硫酸。
(1)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处, 用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(2)经计算,上述浓硫酸的浓度为_______ mol/L。配制100mL1.00mol/L的稀硫酸,应用量筒量取浓硫酸的体积为_______mL(保留一位小数),量取时应选用_______ (填序号①10mL、②50mL 、③100mL)规格的量筒。
(3)请将下列步骤补充完整:
a.量取所需浓硫酸在烧杯中加适量蒸馏水溶解,待溶液冷却到室温后将其沿玻璃棒移入 mL的容量瓶中,并将洗涤液移入容量瓶中。
b.向容量瓶内加水,直到液面接近刻度线 cm时,改用 小心地加水至溶液凹液面与刻度线相切。
c.将容量瓶盖好瓶盖,摇匀。
(4)配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果 ;
所用容量瓶未干燥,则结果 ;
定容时俯视,则结果 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com