
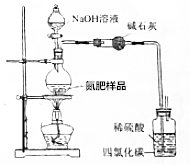
 用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).
用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).分析 (1)根据n=cV计算NaOH的物质的量,再根据m=nM计算NaOH的质量;
(2)待充分反应后需继续向烧瓶中鼓入空气一段时间是利用空气把生成的氨气全部带入浓硫酸中吸收;
(3)浓硫酸中增重的质量为生成氨气的质量,计算得到铵根离子的物质的量结合以上守恒列方程计算样品中碳酸氢铵的质量得到质量分数.
解答 解:(1)n(NaOH)=0.1L×5.0mol/L=0.5mol,则m(NaOH)=0.5mol×40g/mol=20.0g,
故答案为:20.0g;
(2)为提高实验的准确性,待充分反应后需继续向烧瓶中鼓入空气一段时间,其目的是:把生成的氨气全部带入浓硫酸中吸收,
故答案为:把生成的氨气全部带入浓硫酸中吸收;
(3)取7.59g样品与NaOH溶液混合,完全溶解后,加热充分反应,并使生成的氨气被稀硫酸吸收,测得稀硫酸增重1.7g,增重为氨气质量,
①氮元素守恒得到铵根离子物质的量=氨气物质的量=$\frac{1.7g}{17g/mol}$=0.1mol,故答案为:0.1;
②NH4HCO3中含(NH4)2CO3,设碳酸氢铵物质的量为x,碳酸氨物质的量为y,则
79x+96y=7.59g
x+2y=0.1
x=0.09mol
y=0.005mol
NH4HCO3的质量分数=$\frac{0.09mol×79g/mol}{7.59g}$×100%=93.7%,
故答案为:93.7%.
点评 本题考查了混合物含量的实验测定方法、实验方案的设计理解、定量计算等,掌握基础是解题关键,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)2、Fe(OH)3;Fe3O4 | B. | Fe(OH)2;FeO | ||
| C. | Fe(OH)2、Fe(OH)3;Fe2O3 | D. | Fe2O3;Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO${\;}_{3}^{2-}$+H2O | |
| B. | 向澄清石灰水中通入过量CO2;Ca2++2OH-+CO2=CaCO3↓++H2O | |
| C. | 硫酸氢钠溶液中加入过量氢氧化钡溶液:2HSO${\;}_{4}^{-}$+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量石灰水:Ca2++OH-+HCO${\;}_{3}^{-}$=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com