
| A. | 2CH3COOH+BaCO3→(CH3COO)2Ba+CO2↑+H2O | |
| B. | CH3COOH+KHCO3→CH3COOK+CO2↑+H2O | |
| C. | 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O | |
| D. | CH3COOH+Na2CO3→CH3COONa+NaHCO3 |
分析 要证明乙酸酸性比碳酸酸性强,可利用“强酸制弱酸的原理”分析,即:CH3COOH与BaCO3、KHCO3、Na2CO3溶液反应生成二氧化碳气体,注意生成的必须为碳酸,不能为碳酸氢盐,据此进行判断.
解答 解:A.2CH3COOH+BaCO3→(CH3COO)2Ba+CO2↑+H2O,乙酸从碳酸钡中置换出碳酸,证明乙酸酸性比碳酸酸性强,故A不选;
B.CH3COOH+KHCO3→CH3COOK+CO2↑+H2O,乙酸将碳酸氢钾置换出碳酸,证明酸性:乙酸>碳酸,故B不选;
C.2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O,乙酸与碳酸钠反应生成碳酸,证明证明酸性:乙酸>碳酸,故C不选;
D.CH3COOH+Na2CO3→CH3COONa+NaHCO3,乙酸与碳酸钠反应生成碳酸氢钠,只能证明酸性:乙酸>HCO3-,无法证明乙酸酸性比碳酸酸性强,故D选;
故选D.
点评 本题考查了酸性强弱比较,题目难度不大,明确“强酸制弱酸的反应原理”为解答关键,注意掌握判断酸性强弱的常用方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
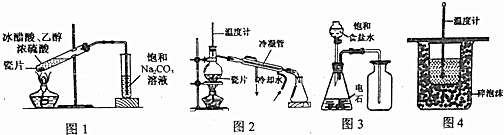
| A. | 用图1装置制取少量乙酸乙酯 | B. | 用图2装置分离苯和溴苯 | ||
| C. | 用图3装置制取并收集乙炔气体 | D. | 用图4装置测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、KOH、RbOH的碱性逐渐增强 | B. | HCl、H2S、PH3的稳定性逐渐减弱 | ||
| C. | Na、K、Rb的原子半径依次增大 | D. | HF、HCl、HBr、HI的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
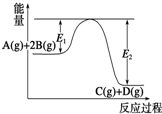
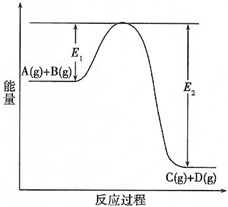
| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
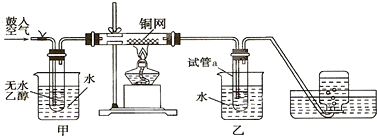
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二项 | B. | 三项 | C. | 五项 | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HS-+H2O?S2-+H3O+ | B. | SO3+H2O?HSO4-+H3O+ | ||
| C. | HCO3-+H2O?CO32-+H3O+ | D. | NH4++2H2O?NH3•H2O+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0mL | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | 0mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0mL | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com