
分析 (1)22.4g铁粉的物质的量为:$\frac{22.4g}{56g/mol}$=0.4mol,标准状况下4480mL氢气的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,生成0.2mol氢气消耗Fe的物质的量为0.2mol,则反应2Fe3++Fe=3Fe2+消耗铁粉的物质的量为0.2mol,设Fe2O3和Fe3O4分别为xmol和ymol,并据Fe2O3+6HCl=2FeCl3+3H2O,Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
,Fe+2HCl=FeCl2+H2↑,建立起x,y之间的关系,进而求得Fe2O3和Fe3O4物质的量,并求质量;
(2)固体恰好完全溶解,所得溶液中加入KSCN溶液,无血红色出现,反应后溶液中的溶质为FeCl2,根据氯元素守恒n(HCl)=2n(FeCl2)=0.36L×5mol/L,故n(FeCl2)=0.9mol,并据c(FeCl2)=$\frac{n}{V}$进行计算;
解答 解:(1)22.4g铁粉的物质的量为:$\frac{22.4g}{56g/mol}$=0.4mol,标准状况下4480mL氢气的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
设Fe2O3和Fe3O4分别为xmol和ymol,
Fe2O3+6HCl=2FeCl3+3H2O
1 6 2
x 6x 2x
则:n1(HCl)=6x,n1(FeCl3)=2x,
Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
1 8 2 1
y 8y 2y y
则:n2(HCl)=8y,n2(FeCl3)=2y,n1(FeCl2)=y,
Fe+2HCl=FeCl2+H2↑
1 2 1 1
0.2 0.4 0.2 0.2
则:n1(Fe)=0.2mol,n3(HCl)=0.4mol,n2(FeCl2)=0.2mol,
据2Fe3++Fe=3Fe2+消耗铁粉的物质的量为0.4mol-0.2mol=0.2mol,则n(Fe3+)=0.4mol,n3(Fe2+)=0.6mol,根据元素守恒故n(Fe3+)=n1(FeCl3)+n2(FeCl3)=2x+2y=0.4①,消耗盐酸总量为6x+8y+0.4=0.36L×5mol/L②,联立①②解得x=0.1mol,y=0.1mol,则n(Fe2O3)=0.1mol,n(Fe3O4)=0.1mol,
故w=m(Fe2O3)+m(Fe3O4)=0.1mol×160g/mol+0.1mol×232g/mol=39.2g,
故答案为:39.2g;
(2)固体恰好完全溶解,所得溶液中加入KSCN溶液,无血红色出现,反应后溶液中的溶质为FeCl2,根据氯元素守恒n(HCl)=2n(FeCl2)=0.36L×5mol/L,故
n(FeCl2)=0.9mol,c(FeCl2)=$\frac{0.9mol}{0.36L}$=2.5mol/L,
故答案为:2.5mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握元素守恒定律在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:实验题
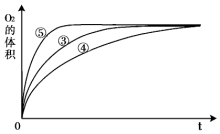 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色固体一定只含有硫酸铵 | |
| B. | 若氢氧化钠溶液足量,则生成氨气的体积应为6.72L(标况) | |
| C. | 从上述数据能求算出白色固体中(NH4)2SO4、NH4HSO4的物质的量之比为1:2 | |
| D. | 将某白色固体加热分解,若产生的气体不能使湿润的红色石蕊试纸变蓝,则该固体中一定不含铵盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol羟基与1mol氢氧根离子所含有的电子数目均为9NA | |
| B. | 电解饱和食盐水,当阴极产生2.24L气体时,转移的电子数为0.2NA | |
| C. | 7.8gNa2O2和Na2S的混合物中含有的离子总数为0.7NA | |
| D. | 常温下,1L0.1mol/LNa2CO3溶液中,含有离子的总数大于0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
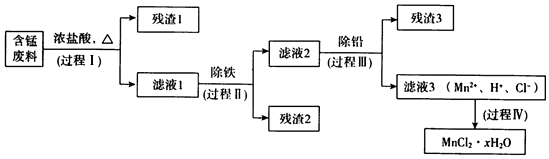
| Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 8.1 | 6.5 | 1.9 |
| 完全沉淀时 | 10.1 | 8.5 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 25℃时,KSP(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA | |
| C. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 常温下,1mol的NaHCO3固体中含HCO3-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com