
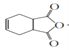
【题目】以C2H2为原料合成环丁烯类化合物L的路线如下:
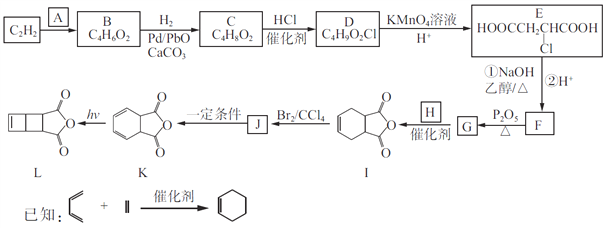
(1)A由碳、氢、氧三种元素组成,相对分子质量是30,则A的名称为____________。
(2)B分子中的碳原子都在同一直线上,B的结构简式为________________。
(3)C→D、J→K的反应类型分别为________________、________________。
(4)设计C→D、E→F两步反应的目的是________________________。
(5)G和H生成I的化学方程式为______________________。
(6)化合物X是I的同分异构体,可与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应放出CO2,X共有__种(不考虑立体异构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为____________________。
(7)写出用![]() 和乙炔为原料制备
和乙炔为原料制备![]() 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
【答案】 甲醛 HOCH2-C≡C-CH2OH 加成反应 消去反应 保护碳碳双键不被氧化 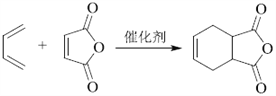 13
13 ![]()
【解析】试题分析:A由碳、氢、氧三种元素组成,相对分子质量是30,则A是HCHO;C2H2与HCHO反应生成B,根据B的分子式C4H6O2,可知C2H2与HCHO反应是加成反应,结合E的结构简式,B是HOCH2-C≡C-CH2OH;HOCH2-C≡C-CH2OH与氢气1:1发生加成反应生成C4H8O2,则C是HOCH2-CH=CH-CH2OH;HOCH2-CH=CH-CH2OH与HCl发生加成反应生成C4H9O2Cl,C4H9O2Cl的结构简式是HOCH2-CH2CHCl-CH2OH;HOCH2-CH2CHCl-CH2OH被氧化为![]() ;
;![]() 在氢氧化钠的醇溶液中发生消去反应生成F,则F是HOOC-CH=CH-COOH;由I逆推G是
在氢氧化钠的醇溶液中发生消去反应生成F,则F是HOOC-CH=CH-COOH;由I逆推G是![]() ,H是
,H是![]() ;
; 与溴的四氯化碳溶液发生加成反应生成J,则J是
与溴的四氯化碳溶液发生加成反应生成J,则J是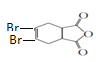 ,
, 在氢氧化钠的醇溶液中发生消去反应生成
在氢氧化钠的醇溶液中发生消去反应生成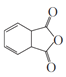 。
。
解析:根据以上分析,(1)A是HCHO, A的名称为甲醛。 (2) C2H2与HCHO反应是加成反应生成B,B的结构简式为HOCH2-C≡C-CH2OH。 (3) HOCH2-CH=CH-CH2OH与HCl发生加成反应生成HOCH2-CH2CHCl-CH2OH、J→K是 在氢氧化钠的醇溶液中发生消去反应生成
在氢氧化钠的醇溶液中发生消去反应生成 。 (4)碳碳双键易被氧化,设计C→D、E→F两步反应的目的是保护碳碳双键不被氧化。 (5)
。 (4)碳碳双键易被氧化,设计C→D、E→F两步反应的目的是保护碳碳双键不被氧化。 (5) ![]() 和
和![]() 发生加成反应生成
发生加成反应生成 的化学方程式为
的化学方程式为 。 (6)与FeCl3溶液发生显色反应,说明含有苯环和酚羟基,且能与NaHCO3溶液反应放出CO2,说明含有羧基,符合条件的I的同分异构体若苯环上有
。 (6)与FeCl3溶液发生显色反应,说明含有苯环和酚羟基,且能与NaHCO3溶液反应放出CO2,说明含有羧基,符合条件的I的同分异构体若苯环上有![]() 三个取代基有10种结构,若有
三个取代基有10种结构,若有![]() 两个取代基有3种结构,共有13种结构;其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为
两个取代基有3种结构,共有13种结构;其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为![]() 。
。
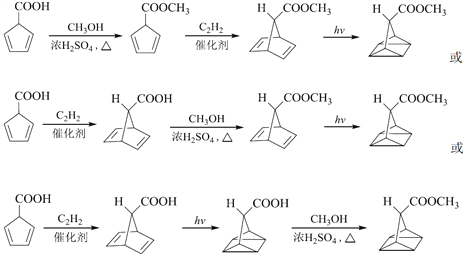
(7)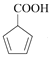 与甲醇发生酯化反应生成
与甲醇发生酯化反应生成 ,
,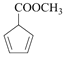 再与乙炔发生反应生成
再与乙炔发生反应生成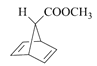 ,
, 在光照条件下生成
在光照条件下生成![]() ,所以合成路线为
,所以合成路线为
 。
。


科目:高中化学 来源: 题型:
【题目】氧气性质的微型实验装置如图所示,①是浓盐酸,⑥是高锰酸钾,②至⑤是滤纸条,依次滴有石蕊试液、淀粉KI试液、KBr溶液、含KSCN的FeCl2几种溶液,实验时滴几滴浓盐酸,下列说法不正确的是
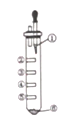
A. 产生氯气的离子方程式为:16H++10C1-+2MnO4-=2Mn2++5Cl2↑+8H2O
B. ⑤处变红色,发生反应为:2Fe2++Cl2=2Fe3++2C1-,Fe3++3SCN-=Fe(SCN)3
C. ②处先变红后褪色,能说明氯气溶于水后,溶液有酸性和强氧化性
D. ③处变蓝,④处变橙色能说明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳资源”正成为科学家研究的主要课題,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ·mol-1
①己知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1
则反应:3FeO(s)+H2O(g)= Fe3O4(s)+ H2(g)的△H=______________。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分別用不同pH的吸收剤吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如下图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为_________ (精确到0.01)。

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是_________________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如下图所示。

①该反应的化学方程式为___________________;反应过程中碳元素的化合价为-2价的中间体是__________________________。
②向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8 mol·L-1、CH4:0.8 mol·L-1、H2O:1.6 mol·L-1,CO2的平衡转化率为___________________。
③己知该反应正反应放热,现有两个相同的恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是_____________(填字母)。
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
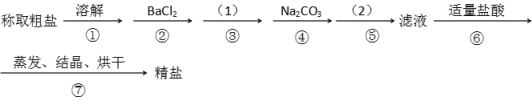
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______________ ;____________。
(2)实验方案的(1)中应使用除杂试剂的化学式__________,发生的离子方程式是__________,在实验方案的(2)中的操作名称是_______。
(3)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。___________________________________________;
(4)判断BaCl2已过量的方法是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写错误的是( )
A. NaHCO3===Na++H++![]()
B. NH4NO3===![]() +
+![]()
C. NaHSO4===Na++H++![]()
D. Ba(OH)2===Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质与应用对应关系正确的是
A. 晶体硅熔点高、硬度大,可用于制作半导体材料
B. 氢氧化钠具有强碱性,可用于疏通下水管道
C. 漂白粉在空气中不稳定,可用于漂白纸张
D. 氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是目前世界上用量最大的金属材料,有关铁及其化合物的说法不正确的是
A. 磁铁矿的成分是Fe3O4B. Fe3+遇KSCN溶液显红色
C. Fe可被冷的浓HNO3钝化D. Fe2+可被还原剂还原为Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.锂离子电池和普通锌锰干电池都是二次电池
B.原电池的反应的本质是氧化还原反应
C.燃料电池是一种高效但是会污染环境的新型电池
D.铅蓄电池放电的时候正极是Pb负极是PbO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com