
| ���� | MgCl2 | Mg��OH��2 | MgCO3 |
| �ܽ�ȣ�g/100g�� | 74 | 0.00084 | 0.01 |
| A�� | ��֪MgCO3��KSp=6.82��10-6mol2•L-2�������к��й���MgCO3����Һ�У�����c��Mg2+��=c��CO32-������c��Mg2+��•c��CO32-��=6.82��10-6mol2•L-2 | |
| B�� | ��ȥ�����к��е�MgCl2���ʣ���ѳ����Լ�ΪNa2CO3��Һ | |
| C�� | �������������ʷֱ���ˮ��ϣ��ֱ���ȡ����գ����յĹ��������ͬ | |
| D�� | ������ʯ��ˮ��������Mg2+��HCO3-��Ӳˮ�����������ӷ�Ӧ����ʽΪMg2++2HCO3-+Ca2++2OH-=CaCO3��+MgCO3��+2H2O |
���� A��c��Mg2+��•c��CO32-��=��6.82����10-6��������һ������c��Mg2+��=c��CO32-����
B���ܽ�ȣ�Mg��OH��2��MgCO3���ʳ�ȥ�����к��е�MgCl2���ʣ���ѳ����Լ�ΪNaOH��
C��MgCl2+2H2O?Mg��OH��2+2HCl������MgCl2��Һ��ƽ�������ƶ���������ƽ�⣬���ɺ�õ�Mg��OH��2������Mg��OH��2��Mg��OH��2�ֽ�õ�MgO��MgCO3+2H2O?Mg��OH��2+H2CO3������MgCO3��Һ��ƽ�������ƶ���������ƽ�⣬���ɺ�õ�Mg��OH��2�����պ�Ҳ�õ�MgO�����������յĹ��������ͬ��
D����ʯ��ˮ��������Mg2+��HCO3-��Ӳˮ�����������ӷ�Ӧ����ʽΪMg2++2HCO3-+2Ca2++4OH-=2CaCO3��+Mg��OH��2��+2H2O��
��� �⣺A��c��Mg2+��•c��CO32-��=��6.82����10-6������һ������c��Mg2+��=c��CO32-������A����
B���ܽ�ȣ�Mg��OH��2��MgCO3���ʳ�ȥ�����к��е�MgCl2���ʣ���ѳ����Լ�ΪNaOH����B����
C��MgCl2+2H2O?Mg��OH��2+2HCl������MgCl2��Һ��ƽ�������ƶ���������ƽ�⣬���ɺ�õ�Mg��OH��2������Mg��OH��2��Mg��OH��2�ֽ�õ�MgO��MgCO3+2H2O?Mg��OH��2+H2CO3������MgCO3��Һ��ƽ�������ƶ���������ƽ�⣬���ɺ�õ�Mg��OH��2�����պ�Ҳ�õ�MgO�����������յĹ��������ͬ����C��ȷ��
D����ʯ��ˮ��������Mg2+��HCO3-��Ӳˮ�����������ӷ�Ӧ����ʽΪMg2++2HCO3-+2Ca2++4OH-=2CaCO3��+Mg��OH��2��+2H2O����D����
��ѡC��
���� ������Ҫ�������ˮ���Ӱ�����أ�ˮ�ⷽ��ʽ������ˮ���ж���Һ����Ի�Ƚ���ҺpHֵ�Ĵ�С������ˮ��Ķ��� �ȿ�������⣬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO�Ի�����Σ�������ƻ������㡢�γ�����ȷ��� | |
| B�� | NO������ijЩ��N���ʵĻ�ԭ����Ҳ������ijЩ���ͼ�N���ʵ��������� | |
| C�� | ʵ������ȡ��NO����������ˮ���������ſ������ռ� | |
| D�� | �������ڴ�������NO��������������ܣ�������Ѫ�ܡ��ٽ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
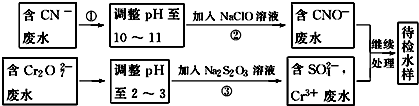
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �Ȼ�ѧ����ʽ | ƽ�ⳣ�� | |
| 500�� | 700�� | |
| ��2H2��g��+CO��g��?CH3OH��g����H1=a kJ•mol-1 | 2.5 | 0.2 |
| ��H2��g��+CO2��g��?H2O��g��+CO��g����H2=b kJ•mol-1 | 1.0 | 2.3 |
| ��3H2��g��+CO2 ��g��?CH3OH��g��+H2O��g����H3=c kJ•mol-1 | K3 | 4.6 |
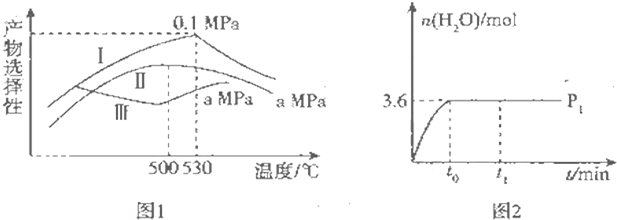
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
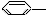 CH3 ��
CH3 ��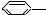 CH=CH2
CH=CH2 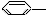 NO2 ��
NO2 �� OH
OH 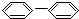 ��
��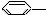 CH-��CH3��2��
CH-��CH3��2��| A�� | �ۢ� | B�� | �ڢ� | C�� | �٢� | D�� | �٢ڢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H4 | B�� | C3H6 | C�� | C2H6 | D�� | C4H8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com