
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在____(高温,低温,任何温度)下可自发进行
CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在____(高温,低温,任何温度)下可自发进行
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_____________。
2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_____________。
A. 混合气体的密度不再发生变化 B.混合气体的平均摩尔质量不再发生变化
C. ![]() (SO2):
(SO2):![]() (O2):
(O2):![]() (SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(3)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。
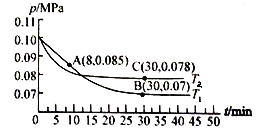
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率![]() 0(正)与A点的逆反应速率
0(正)与A点的逆反应速率![]() A(逆)的大小关系为
A(逆)的大小关系为![]() 0(正)_____
0(正)_____![]() A(逆) (填“>"、“<”或“ = ”)。
A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为____________。
【答案】-875.3 任何温度下 BD 45% > 24300 (a+b+2c)/V mol·L-1
【解析】
(1)根据盖斯定律,反应①-②-2×③得到最终的反应方程式,得 ;从热化学反应方程式看,此反应是一个熵增的放热反应,在任何温度下都可自发进行,本小题答案为:-875.3;任何温度下;
;从热化学反应方程式看,此反应是一个熵增的放热反应,在任何温度下都可自发进行,本小题答案为:-875.3;任何温度下;
(2)A.此反应中参与反应的气体总质量不变且在定容容器中进行,则混合气体的密度始终保持不变,混合气体密度不变不能说明达到平衡状态,故A错误;
B.此反应中参与反应的气体总质量不变,反应后气体总物质的量是变化的,则混合气体的平均摩尔质量也是变化的,混合气体的平均摩尔质量不再变化能说明达到平衡状态,故B正确;
C.无论反应是否达到平衡状态,SO2、O2、SO3三者速率之比都等于化学计量数之比,则C项不能说明达到平衡状态,故C错误;
D.此反应是反应前后总物质的量变化的反应,混合气体的总物质的量不再变化能说明达到平衡状态,故D正确,答案选BD;
(3)①设SO2和O2初始投料分别为2n和n,转化的SO2和O2物质的量分别为2x和x,列式计算
SO2 O2 SO3
初始物质的量/mol 2n n 0
转化物质的量/mol 2x x 2x
平衡物质的量/mol 2n-2x n-x 2x
![]() ,得
,得![]() ,本小题答案为45%;
,本小题答案为45%;
②首先比较A、B两点的逆反应速率,随反应的进行逆反应速率逐渐增大,B的逆反应速率大于A的逆反应速率,B、C两点的正逆反应速率分别相等,T2时反应比T1先到达平衡,证明T2>T1,则C点反应速率大于B点反应速率,所以![]() ,本小题答案为:>;
,本小题答案为:>;
③类比于①中的计算![]() ,x=0.9n,平衡分压为
,x=0.9n,平衡分压为![]() ,
,![]() ,
,![]() ,
,![]() 。本小题答案为:24300;
。本小题答案为:24300;
(4)混合气体发生的反应是:![]() ,
,![]() ,
,![]() ,全部吸收最少消耗的NaOH物质的量为2a+(b-a)+2c=(a+b+2c)mol,所以浓度为
,全部吸收最少消耗的NaOH物质的量为2a+(b-a)+2c=(a+b+2c)mol,所以浓度为![]() ,本小题答案为:
,本小题答案为: ![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列有机反应属于加成反应的是
A. CH4 + Cl2 ![]() CH3Cl + HCl B. CH2=CH2 + HBr → CH3CH2Br
CH3Cl + HCl B. CH2=CH2 + HBr → CH3CH2Br
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组欲探究己烷的性质,用己烷进行下利实验:
实验1:![]()
实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
实验3:根据下图的实验装置进行己烷催化裂化。
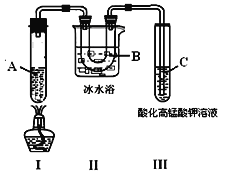
请回答下列问题:
(1)由实验1 知己烷的物理性质有______________;
(2)实验2 中的橙色溶液逐渐变浅的原因是_______;
A.己烷与溴发生发生取代反应 B.溴代己烷为无色物质
C.液溴向外挥发浓度降低 D.己烷与液溴发生加成反应
E.液溴与己烷分层,密度大的液溴在下层
(3)试管C中看到的现象是____________________________,说明有_________生成;
(4)试写出装置Ⅰ中发生有丙烷生成的裂化反应方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式为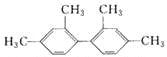 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中至少有9个碳原子处于同一平面上
B. 分子中至少有11个碳原子处于同一平面上
C. 分子中至少有16个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是

A. 用①所示的操作可检查装置的气密性
B. 用②所示的装置制取少量的NO
C. 用③所示的装置干燥H2、NH3、CO2等
D. 用④所示装置制取Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
(制备NaClO溶液)
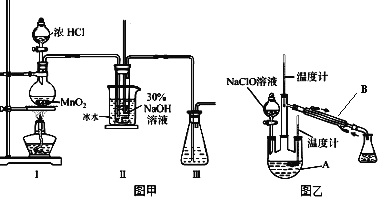
实验装置如图甲所示部分夹持装置已省略
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
(1)请写出肼的电子式_________________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___________。
(3)装置I中发生的化学反应方程式是 ____________________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是______________________________。
(制取水合肼)
实验装置如图乙所示。
(4)仪器B的名称为_________;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,请写出该反应的化学反应方程式_________________。
(5)充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是_____________________。
(测定肼的含量)
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
滴定终点时的现象为_____________________________________。实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g) ![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
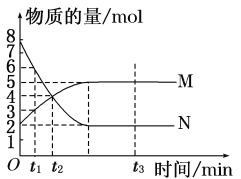
(1)此反应的化学方程式中a∶b=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述中能说明上述反应达到平衡状态的是________________________________________________________________________。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( )

A. M极生成氮气且电极附近溶液酸性增强
B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜
C. 正极的电极反应式为:O2+4H++4e-=2H2O
D. d口流出的液体是蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导滴定是利用溶液的电导改变以确定滴定终点的滴定方法。常温下,将0.10mol·L-1CH2COOH溶液与0.10mo1·L-1HCl溶液以一定体积比混合,用0.10mol·L-1NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是

A. a点溶液的pH=1
B. b点溶液中:c(Na+)=c(Clˉ)+c(CH3COOˉ)
C. 图中四点,C点处溶液中水的电离度最大
D. d点溶液中:c(Na+)>c(Clˉ)>c(CH3COOˉ)>c(OHˉ)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com