
| A. | 质子数为8、中子数为10的氧原子:$\stackrel{18}{8}$O | |
| B. | 氧原子的结构示意图: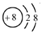 | |
| C. | 水分子的电子式: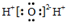 | |
| D. | 乙醛的结构简式:CH3COH |
分析 A.核素符号ZAX,左下角Z代表质子数,左上角A代表质量数,X代表元素符号,Z可以省略,其中质量数=质子数+中子数;
B.根据原子的结构示意图来解答,图示为氧离子结构示意图,氧原子是8号元素,核内质子数为8,核外有2个电子层,第一层2个电子,第二层6个电子;
C.水是共价化合物,原子间通过共用电子对形成化学键;
D.乙醛分子中醛基与甲基相连,省略C-H键即为结构简式,题干书写错误;
解答 解:A.质子数为8,中子数为10的氧原子的质量数为8+10=18,核素符号为818O或18O,故A正确;
B.氧原子核外有8个电子,其电子排布为2、6,所以其结构示意图为 ,故B错误;
,故B错误;
C.水是共价化合物,原子间通过共用电子对形成化学键,其电子式为 ,故C错误;
,故C错误;
D.乙醛分子中醛基与甲基相连,乙醛的结构简式为CH3CHO,故D错误;
故选A.
点评 本题考查常用化学用语,难度不大,掌握规范常用化学用语的书写是解答该类题的关键,注意D常用官能团的结构简式的书写,为易错点.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X | |
| B. | Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡 | |
| C. | 室温下,0.05.mol•L-1U的气态氢化物的水溶液的pH>1 | |
| D. | Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稀释浓硫酸时把水沿着烧杯内壁缓慢注入浓硫酸中,并用玻璃棒搅拌 | |
| B. | 称量2.0gNaOH固体时先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 | |
| C. | 用装置甲除去乙烯中少量SO2气体 | |
| D. | 用装置乙分液,从分液漏斗下口放出有机相,关闭活塞再从分液漏斗上口倒出水相 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
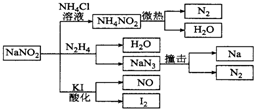
| A. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI-淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2转移6 mole一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
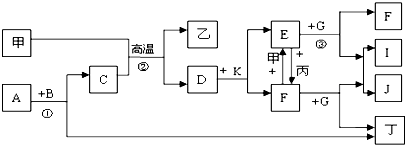
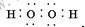 、甲在周期表中位置是第四周期第Ⅷ族;
、甲在周期表中位置是第四周期第Ⅷ族;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com