
分析 (1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-126.4kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.8kJ•mol-1
依据盖斯定律计算②×2-①×2-③得到答案;
(2)①正反应放热,则升高温度CO的转化率降低;计算出平衡时各物质的浓度,结合平衡常数的定义进行计算;平衡常数是温度的函数,正反应是放热反应,温度越高K越小;
②当正逆反应速率不相等时,化学平衡会向着正方向或是逆方向进行;
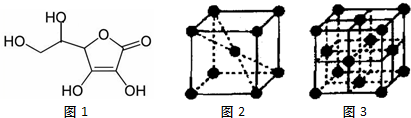
(3)①负极是一氧化碳发生氧化反应,生成二氧化碳;
②根据负极2CO+2CO32--4e-=4CO2,而正极反应为O2+4e-+2CO2═2CO32-.
解答 解:(1)已知:①C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1=-126.4kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.8kJ•mol-1
依据盖斯定律计算②×2-①×2-③得到SO2氧化CO的热化学反应方程式:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-237.4kJ•mol-1;
故答案为:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-237.4kJ•mol-1;
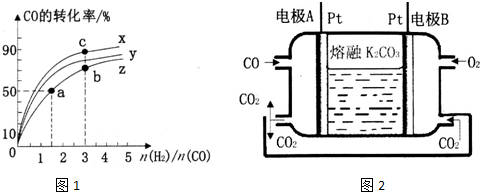
(2)根据该反应为放热反应,温度越高CO的转化率越小,所以曲线Z为270℃,
由图象可知当270℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.5×0.5}$=4,
曲线上a、b是等温,温度高于c点的温度,所以K1═K2<K3,故答案为:270;4;K1═K2<K3;
②化学平衡的标志是正逆反应速率相等,当逆反应速率小于正反应速率时,说明反应是正向进行的,CO(g)+2H2(g)?CH3OH(g)△H<0;
A.正反应速率先增大后减小,说明反应正向进行,故A正确;
B.混合气体的密度增大,可以增加生成物使其密度增大,说明反应逆向进行,故B错误;
C.化学平衡常数K值增大,说明平衡正向进行,故C正确;
D.反应物的体积百分含量增大,可能逆向进行,也可能正向进行,不能说明反应正向进行,故D错误;
故答案为:AC;
(3)①负极是一氧化碳发生氧化反应,生成二氧化碳,电极反应式为:CO+CO32--2e-=2CO2,故答案为:CO+CO32--2e-=2CO2;
②根据负极2CO+2CO32--4e-=4CO2,而正极反应为O2+4e-+2CO2═2CO32-,所以在转移4mol电子相同的情况下负极产生4mol的二氧化碳,而正极消耗2mol的二氧化碳,所以利用率为50%,故答案为:50%.
点评 本题目综合考查盖斯定律的应用、化学反应平衡常数的计算和应用等方面的知识,侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键,题目难度中等.注意(3)燃料电池反应的特点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L NO和O2混合气体的原子数为NA | |
| B. | 15g甲基所含有的电子数目为9NA | |
| C. | 1L0.1mol/L的氨水溶液中含有的N原子数大于0.1NA | |
| D. | 标准状况下,6.72L NO2与水反应转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝和铜常用于导电体,铝被人类大规模开发、使用的时间远超过铜被人类大规模开发和使用的时间 | |
| B. | 使用煤液化的产品作燃料与直接燃烧煤比较,对保护环境有利,目前,煤液化的唯一途径是将煤在高温和催化剂条件下与氢气反应 | |
| C. | 石油分馏的馏分之一是石油气,石油气含有大量的己烷 | |
| D. | 在陶瓷、聚合物中加入固态胶体粒子,可以改进材料的耐冲击强度和耐断裂强度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C12H20O2 | |
| B. | 能发生加成反应、取代反应、氧化反应 | |
| C. | 1mol该有机物在一定条件下能和3mol H2发生反应 | |
| D. | 该有机物仅含有两种不同类型的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的无色溶液中:K+、NH4+、SO42-、MnO4- | |
| B. | 水电离出的c(OH-)=10-12 mo1•L-1的溶液中:Fe2+、Ba2+、NO3-、ClO- | |
| C. | 含大量A13+的溶液中:Na+、SO42-、NO3-、[Al(OH)4]- | |
| D. | CO2的饱和溶液中:K+、Ca2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
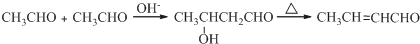
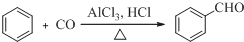
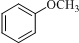 ;D
;D .
.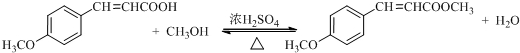 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于HI溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| B. | [Ag(NH3)2]OH的溶液中加入盐酸:Ag++Cl-=AgCl↓ | |
| C. | Na2S2O3溶液吸收Cl2:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液:NH4++Fe2++3OH-=Fe (OH)2↓+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com