
【题目】下列离子方程式书写正确的是
A.在100 mL 1 molL1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++![]() +4H+
+4H+
B.在100 mL 2 molL1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2![]() +Ca2++2OH-═CaCO3↓+2H2O+
+Ca2++2OH-═CaCO3↓+2H2O+![]()
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2![]() +2Ba2++4OH-═2BaSO4↓+
+2Ba2++4OH-═2BaSO4↓+![]() +2H2O
+2H2O
【答案】D
【解析】
A.酸性条件下,硝酸根离子具有强氧化性,漏写硝酸根离子与二氧化硫的反应,反应的离子方程式为Fe3++3![]() +5SO2+4H2O═Fe2++5
+5SO2+4H2O═Fe2++5![]() +8H++3NO↑,故A错误;
+8H++3NO↑,故A错误;
B.n(Fe2+)=0.2mol,n(I-)=0.4mol,![]() ,由电子守恒及优先氧化可知,碘离子全部被氧化,亚铁离子部分被氧化,反应的离子方程式为2Fe2++8I-+5Cl2═2Fe3++4I2+10Cl-,故B错误;
,由电子守恒及优先氧化可知,碘离子全部被氧化,亚铁离子部分被氧化,反应的离子方程式为2Fe2++8I-+5Cl2═2Fe3++4I2+10Cl-,故B错误;
C.向NaHCO3溶液中加入过量的澄清石灰水生成碳酸钙沉淀、氢氧化钠和水,根据少定多变思想,少的定为1mol,因此应为![]() +Ca2++OH-═CaCO3↓+H2O,故C错误;
+Ca2++OH-═CaCO3↓+H2O,故C错误;
D.向明矾溶液中加入过量的氢氧化钡溶液生成硫酸钡和偏铝酸根离子,反应的离子方程式为Al3++2![]() +2Ba2++4OH-═2BaSO4↓+
+2Ba2++4OH-═2BaSO4↓+![]() +2H2O,故D正确。
+2H2O,故D正确。
综上所述,答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是
A.使用铁触媒,加快合成氨反应速率
B.过量空气有利于SO2转化为SO3
C.打开汽水瓶盖,即有大量气泡逸出
D.将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为n![]() +(n+1)HO(CH2)4OH
+(n+1)HO(CH2)4OH![]()
![]() 。下列说法错误的是( )
。下列说法错误的是( )
A.![]() 的沸点高于
的沸点高于![]()
B.高分子材料PU在强酸、强碱条件下能稳定存在
C.合成PU的两种单体的核磁共振氢谱中均有3组吸收峰
D.以1,![]() 丁二烯为原料,可合成
丁二烯为原料,可合成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上利用金属镍废料(含镍、铁、铝)生产氯化镍晶体(NiCl2·6H2O)流程如下:
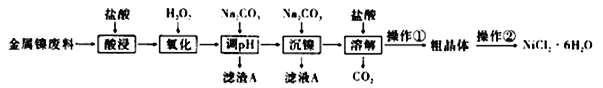
下表列出了相关金属离子生产氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Al(OH)3 |
开始沉淀的pH | 7.6 | 2.7 | 7.1 | 3.7 |
沉淀完全的pH | 9.6 | 3.7 | 9.2 | 4.7 |
回答下列问题:
(1)加入H2O2氧化时发生反应的离子方程式为______,调pH的范围为_______,若调pH=6,则溶液中c(Al3+):c(Fe3+)=________。(已知Ksp[Al(OH)3]=1×10-34,Ksp[Fe(OH)3]=1×10-38)
(2)滤液A的溶质主要是_______。
(3)操作①的实验方法依次是_________、冷却结晶、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.2-甲基丁烷也称异丁烷
B.C4H9Cl有3种同分异构体
C.正丁烷的4个碳原子可以在同一直线上
D.甲烷、乙烷、丙烷的结构都只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“>”“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的![]() 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗盐中常含有少量泥沙及Ca2+、Mg2+、SO42-等杂质离子。为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1)为除去Ca2+、Mg2+、SO42-,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量);加入的顺序为_____________(填字母)。
A.Na2CO3 B.BaCl2 C.NaOH
(2)请写出步骤⑥中涉及反应的离子方程式: ______________________________________。
(3)粗盐提纯的整个操作过程中多处使用到玻璃棒,步骤⑦蒸发过程中使用玻璃棒的作用是_____________________________________。
(4)若先加盐酸再过滤,将对提纯效果产生影响,其原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种无机物之间的转化关系如下图所示(反应条件省略,部分产物省略)。下列推断不正确的是( )

A.若L为强碱,则E可能为NaCl溶液、F为K
B.若L为强酸,则E可能为Na2S、F为H2O2
C.若L为弱酸,则E可能为Mg、F为CO2
D.若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员利用Cu/ZnO作催化剂,在光照条件下实现了CO2和H2合成CH3OH,该反应历程示意图如下。
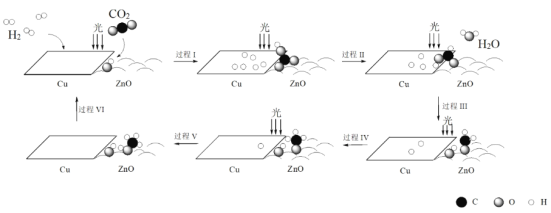
下列说法不正确的是
A.过程I中ZnO表面上进行CO2的吸附与转化
B.过程II中存在极性键的断裂与形成
C.过程V中生成CH3OH时吸收能量
D.总反应的化学方程式是CO2 + 3H2![]() CH3OH + H2O
CH3OH + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com