
 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:分析 (1)由盖斯定律可知,②×2-①×2得2CH4(g)+O2(g)═2CO(g)+4H2(g)以此计算△H;
(2)正极是MnO2得到电子发生还原反应生成Mn2O3,负极镁失电子生成的镁离子和氢氧根结合生成氢氧化镁沉淀;
(3)前5min 内生成CaO的质量为11.2g,n(CO)=n(CaO)=$\frac{11.2g}{56g/mol}$=0.2mol,则v(CO)=$\frac{0.2mol}{1L•5min}$=0.04mol•L-1•min-1;温度不变,平衡常数不变,t0时刻,将容器体积缩小为原来的一半并固定不变,c(CO2)=2c,在t1时刻再次达到平衡时,c(CO2)=c,作图即可;
(4)①醋酸的酸性大于碳酸的酸性,小于草酸的酸性,故醋酸与CaC2O4不反应,与CaCO3反应有气泡逸出;
②该反应的K=$\frac{{c({C_2}O_4^{2-})}}{{c(CO_3^{2-})}}$=$\frac{{c({C_2}O_4^{2-})•c(C{a^{2+}})}}{{c(CO_3^{2-})•c(C{a^{2+}})}}$=$\frac{{Ksp(Ca{C_2}{O_4})}}{{Ksp(CaC{O_3})}}$=$\frac{{5.0×{{10}^{-9}}}}{{2.5×{{10}^{-9}}}}$=2.0,设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x),
结合K的表达式计算.
解答 解:(1)①C(s)+2H2(g)═CH4(g)△H1=a kJ•mol-1;
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2=b kJ•mol-1;
依据盖斯定律:②×2-①×2得2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=2(b-a)kJ•mmol-1;
故答案为:2(b-a)kJ•mmol-1;
(2)正极是MnO2得到电子发生还原反应生成Mn2O3,负极镁失电子生成的镁离子和氢氧根结合生成氢氧化镁沉淀,Mg-2e-+2OH-=Mg(OH)2,
故答案为:还原;Mg+2OH--2e-=Mg(OH)2;
(3)前5min 内生成CaO的质量为11.2g,n(CO)=n(CaO)=$\frac{11.2g}{56g/mol}$=0.2mol,则v(CO)=$\frac{0.2mol}{1L•5min}$=0.04mol•L-1•min-1;温度不变,平衡常数不变,t0时刻,将容器体积缩小为原来的一半并固定不变,c(CO2)=2c,在t1时刻再次达到平衡时,c(CO2)=c,作图如下: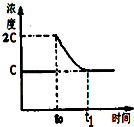 ,
,
故答案为:0.04mol•L-1•min-1; ;
;
(4)①醋酸的酸性大于碳酸的酸性,小于草酸的酸性,故醋酸与CaC2O4不反应,与CaCO3反应有气泡逸出;
故答案为:一种固体溶解同时产生气泡逸出,另一种固体无现象;
②该反应的K=$\frac{{c({C_2}O_4^{2-})}}{{c(CO_3^{2-})}}$=$\frac{{c({C_2}O_4^{2-})•c(C{a^{2+}})}}{{c(CO_3^{2-})•c(C{a^{2+}})}}$=$\frac{{Ksp(Ca{C_2}{O_4})}}{{Ksp(CaC{O_3})}}$=$\frac{{5.0×{{10}^{-9}}}}{{2.5×{{10}^{-9}}}}$=2.0,
设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x),
可得方程:$\frac{x}{(0.6-x)}$=2.0,解得x=0.4 mol•L?1;
故答案为:0.4 mol•L?1.
点评 本题考查盖斯定律、原电池原理的应用、弱酸的性质等知识,综合性较强,难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | 中性溶液中:Fe3+、K+、Cl-、SO42- | |
| B. | 在澄清透明溶液中:NH4+、Cu2+、Cl-、SO42- | |
| C. | 酸性溶液中:Na+、K+、ClO-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、K+、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | … | 23 | 24 |
| C2H6 | C2H6O | C2H4O2 | C3H8 | C3H8O | C3H6O2 | C4H10 | … | M | N |
| A. | M为C9H20O | B. | N为C9H18O2 | ||
| C. | M、N均可发生加成反应 | D. | M、N均可能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等物质的量浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH)溶液 | |
| C. | 向0.2mol/L的盐酸溶液中加入等体积0.1mol•L-1的NH3•H2O溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
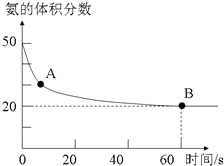 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示稀释冰醋酸过程中溶液导电性的变化曲线 | |
| B. |  曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 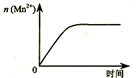 表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 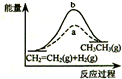 a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-、Fe2+、K+、Cl- | B. | Ca2+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Cl-、NO3-、K+ | D. | Ca2+、H+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH→CH2=CH2↑+H2O | |
| B. | CH3CHBrCH3+NaOH→CH3CH=CH2↑+NaBr+H2O | |
| C. |  CHClCH2Cl+2NaOH→ CHClCH2Cl+2NaOH→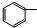 C≡CH+2NaCl+2H2O C≡CH+2NaCl+2H2O | |
| D. | 2CH3OH→CH3-O-CH3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com