
| A. | 金属与非金属分界线附近 | B. | 非金属区域 | ||
| C. | 过渡元素 | D. | 左下方的金属元素区域 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:多选题
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 | |
| B. | 氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应 | |
| C. | 工业合成氨通常采用500℃的高温主要是为了提高氮气的转化率 | |
| D. | 电解精炼铜时,纯铜作为阳极,粗铜作为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).
,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).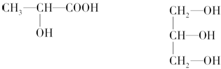
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.
 .
.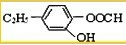 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
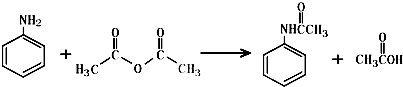
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com