
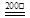 FeS2↓+2H+ + SO42-
FeS2↓+2H+ + SO42-

科目:高中化学 来源:不详 题型:单选题
| A.烧杯中有铜无铁 |
| B.烧杯中有铁无铜 |
| C.烧杯中铁、铜都有 |
| D.烧杯中铁、铜都无 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此陨石是一种纯度较高的硅酸盐矿石 |
| B.此陨石具有耐酸碱的特性 |
| C.陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D.橄榄石中Fe为+2价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
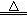 2KNO2+O2↑ Fe(NO3)2
2KNO2+O2↑ Fe(NO3)2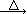 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 | ,说明分解产生的气体中含有NO2。 |
| 步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶, 在最后一个出口检验。 | ,说明分解产生的气体中含O2。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO a > b | B.乙醇溶液 a =b |
| C.NaHSO4 a > b | D.石灰水 a < b |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
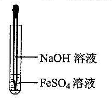
| A.氢氧化亚铁易被空气氧化 |
| B.氢氧化亚铁为灰绿色絮状沉淀 |
| C.可利用右图所示装置,制备氢氧化亚铁 |
| D.实验中所用氢氧化钠溶液应预先煮沸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用铝锅炒菜比用铁锅好 |
| B.Fe2O3俗称铁红,常用作红色油漆和涂料 |
| C.黑色的FeO不溶于水,也不溶于盐酸 |
| D.FeSO4溶液在空气中可长期存放,不会变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com