
| A、金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B、氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C、氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D、干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、c(H+)<c(OH-) |
| D、c(CH3COO-)>+c(CH3COOH)=0.02mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+(g)+Cl-(g)═NaCl(s)△H |
| B、Na(s)+12Cl2(g)═NaCl(s)△H1 |
| C、Na(g)-e-═Na+(g)△H2 |
| D、Cl(g)+e-═Cl-(g)△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | 电负性 | 元素符号 | 电负性 |
| Li | 0.98 | Be | 1.57 |
| B | 2.04 | C | 2.55 |
| O | 3.44 | F | 3.98 |
| Na | 0.93 | Al | 1.61 |
| Si | 1.90 | P | 2.19 |
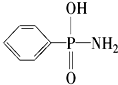 ,在P-N键中,你认为共用电子对偏向
,在P-N键中,你认为共用电子对偏向查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温室效应--二氧化碳 |
| B、光化学污染--二氧化氮 |
| C、酸雨--二氧化碳 |
| D、臭氧层破坏--氟氯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若a=b=3,8>m>n>b,则元素非金属性:X>Y |
| B、若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y<X |
| C、若Y的气态氢化物化学式为YHn,且b<4,则该氢化物易溶于水 |
| D、若a<b=3,m=n=7,已知原子半径大小:Y>N(氮原子)>X,则NX3、NY3与水反应生成不同的含氮化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
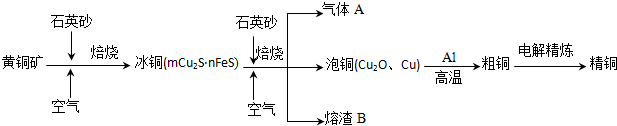
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com