
【题目】下列有关惰性电极电解AgNO3溶液一段时间后的说法,正确的是( )
A.电解过程中阴极质量不变
B.电解过程中溶液的pH不断升高
C.此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况
D.电解后两极产生的气体体积比为2:1
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液,⑥蒸发。正确的操作顺序是
A.①④②⑤①③⑥B.①②⑤④①③⑥
C.①④②⑤③①⑥D.①②⑤④③①⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
(1)实验室可用下图所示装置合成氨。
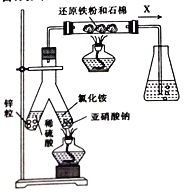
①亚硝酸钠与氯化铵反应的离子方程式为_____________________。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、_____和____(填化学式)
(2)最近斯坦福大学研究人员 发明 了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。
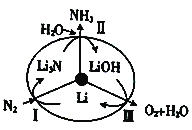
①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨气化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ.mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热△H=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由C、H、O组成的化合物X的球棍模型如图所示,下列说法正确的是

A. 该有机物易溶于水
B. 酸性条件下水解可生成摩尔质量相等的两种有机物
C. 与X互为同分异构体的羧酸有3种
D. 与X互为同分异构体的酯类有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( ) 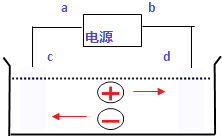
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)
C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-l
D. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是
A.CaCl2 = Ca2++2Cl-B.Na2SO4 = Na22++SO42-
C.HNO3 == H++NO3-D.NaOH = Na++OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的pH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+2OH--2e-=== ClO-+H2O
C. 阴极附近碱性增强,阳极附近碱性减弱
D. 除去CN-的反应:5ClO-+2CN-+2H+ === N2↑+2CO2↑+5Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种重要的金属,锌及其化合物有着广泛的应用.
(1)指出锌在周期表中的位置:第周期第族,属于区.
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式;葡萄糖分子[CH2OHCHOH(CHOH)3CHO]中碳原子杂化方式有 .
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+ . 配位体NH3分子中心原子的 杂化方式是 , 属于(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中用箭头表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键 . 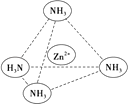
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com