
| A. | 4℃时40ml水 | B. | 0.8mol硫酸 | ||
| C. | 9.03×1022个氧分子 | D. | 54g铝 |
分析 根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水、Al的物质的量,根据n=$\frac{N}{{N}_{A}}$计算氧气分子物质的量.
解答 解:A.4℃时水的密度为1g/mL,40ml水的质量为40g,其物质的量为$\frac{40g}{18g/mol}$=2.2mol;
B.0.8mol硫酸;
C.9.03×1022个氧分子的物质的量为$\frac{9.03×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.15mol;
D.54gAl的物质的量为$\frac{54g}{27g/mol}$=2mol,
故选A.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | Mg为电池的负极 | B. | 正极反应为:AgCl+e-═Ag+Cl- | ||
| C. | 不能被KCl 溶液激活 | D. | 可用于海上应急照明供电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同体积、相同pH的三种溶液:①CH3COOH、②HCl、③H2SO4,中和NaOH的物质的量由大到小的顺序是:①>③>② | |
| B. | NaHCO3溶液中有:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 相同浓度的下列溶液:①CH3COONH4、②CH3COONa、③CH3COOH中,c(CH3COO-)由大到小的顺序是:②>①>③ | |
| D. | pH=4的Al2(SO4)3溶液中,水电离出H+的物质的量浓度为10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHSO4 和 Ba(OH)2 | B. | MgCl2和 NH3•H2O | C. | NaAlO2 和 H2SO4 | D. | AlCl3 和 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
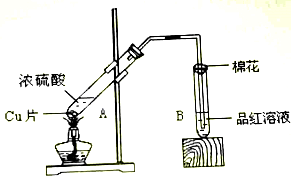
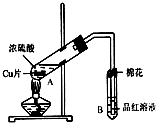 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
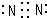 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同素异形体 | B. | 乙醇的分子式:C2H6O | ||
| C. | NH4Cl的电子式: | D. | 羟基的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,X分子的空间构型为三角锥形.
,X分子的空间构型为三角锥形.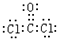 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com