
| A. | 酒精和水 | B. | 汽油和水 | C. | 苯和水 | D. | 四氯化碳和水 |
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
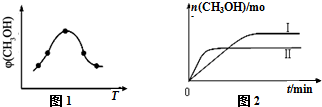
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
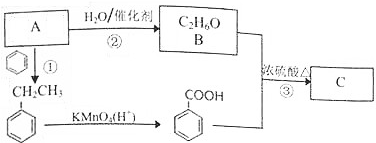
 +CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$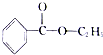 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与铁粉 | B. | 二氧化碳与石灰水 | ||
| C. | 锌与硫酸 | D. | 碳酸钠与硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到冷浓硝酸中:2Al+6H+=2Al3++3H2↑ | |
| B. | 铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| D. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
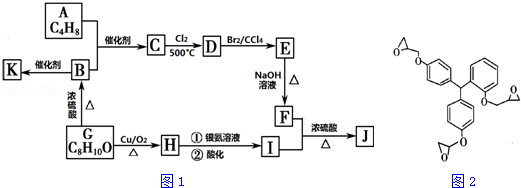
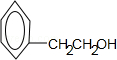 .
. ;F+I→J
;F+I→J .
.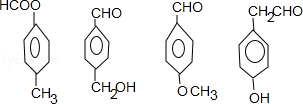 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
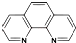 ),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.
),它能与Fe2+形成红色配合物(如图甲),该配离子中Fe2+与氮原子形成配位键共有6个.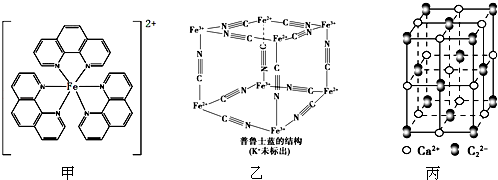
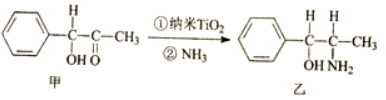
 ,其中σ键与π键数目之比为1:2.
,其中σ键与π键数目之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
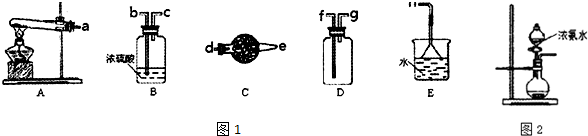
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com