
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
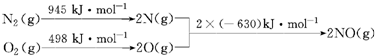
分析 (1)根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
(3)化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和.在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键;
(4)可以运用盖斯定律来计算化学反应的焓变;
(5)依据热化学方程式和盖斯定律计算得到;
解答 解:(1)该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol;
(3)反应热=反应物的键能之和-生成物的键能之和,即△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol,故答案为:+236KJ/mol;
(4)热化学方程式4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4可以将下列三个反应相加得到:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1;6Ca3(PO4)2(s)+30C(s)=3P4(g)+18CaO(s)+30CO(g)3△H2;18SiO2(s)+18CaO(s)=18CaSiO3(s)18△H3;根据盖斯定律可得△H=△H1+3△H2+18△H3,
故答案为:△H1+3△H2+18△H3;
(5)①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ/mol
③H2(g)+1/2O2(g)=H2O(l)△H=-285.84kJ/mol
依据盖斯定律①+$\frac{1}{2}$②+③得到:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol;
故答案为:Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol;
点评 本题考查了热化学方程式的计算书写,盖斯定律的计算应用,题目难度中等.注意基础的掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
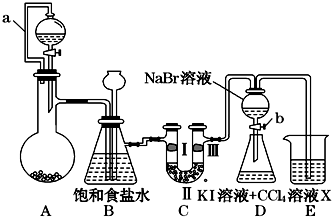 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用渗析的方法制制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | ${\;}_{8}^{18}$O2-离子结构示意图 | |
| D. | 冰酸酸、铝热剂、硫酸钡、SO2分别屈于酸、混合物、强电解质、非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Na2O2与H2O反应制备O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | 向FeBr2溶液中通入足量氯气:2Fe2++2Br-+3Cl2═2Fe3++Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
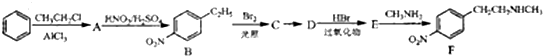
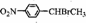 .
.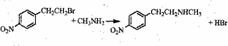 .
.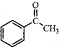 )常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线
)常用作有机化学合成的中间体,参照上述合成F的部分步骤,设计一条以苯为起始原料制备苯乙酮的合成路线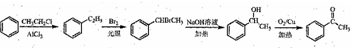 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com