
(14分)某学生用0.l000mol.L-l盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50 g含有少量杂质的固体烧碱样品配制500 mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要 。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“O”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“O”刻度线以下,并记录读数
Ⅲ.移取20.OOmL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ,用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号) ,该错误操作会导致测定结果 (填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应 :判断滴定终点的现象是 。
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果 (填“偏大”、“偏小”或“无影响’')。
(3)按正确操作测得有关数据记录如下:
|
滴定次数 |
待测液体积 |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.20 |
20.38 |
|
第二次 |
20.00 |
4.00 |
24.20 |
|
第三次 |
20.00 |
2.38 |
a |
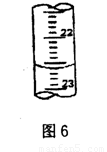
①a的读数如图6所示,则a= ;
②烧碱样品的纯度为 % 。
(1) 500ml容量瓶 (2)①Ⅰ 偏大
②注视锥形瓶中溶液颜色的变化 溶液由红色刚好变为无色,且半分钟内不变色
③偏小 (3) ①22.60 ②80.8%
【解析】(1)根据配制原理可知,还需要500ml容量瓶。
(2)①滴定管再装入标准液之前需要润洗,所以Ⅰ是错误的。只有会导致盐酸的浓度降低,消耗盐酸的体积增大,最终测定结果偏大。
②步骤Ⅳ中滴定时眼睛应注视锥形瓶中溶液颜色的变化;由于是盐酸滴定氢氧化钠,所以终点时的颜色变化是溶液由红色刚好变为无色,且半分钟内不变色。
③若步骤II中仰视读数,则读数偏大,所以消耗的盐酸体积偏小,测定结果偏小。
(3)①根据滴定管的液面可知,此时读数是22.60ml。
②三次实验中消耗的盐酸体积分别是20.18ml、20.20ml、20.22ml,所以消耗盐酸的平均值是(20.18ml+20.20ml+20.22ml)÷3=20.20ml。所以氢氧化钠的浓度是20.20×0.1000mol/L÷20.00ml=0.1010mol/L,则原样品中氢氧化钠的质量是0.1010mol/L×0.5L×40g/mol=2.02g,则其纯度是2.02÷2.5×100%=80.8%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 21.30 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
某学生用0.2000mol?L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com