
| A. | FeSO4 (CuSO4):加足量铁粉后,过滤 | |
| B. | CO (CO2):用NaOH溶液洗气后干燥 | |
| C. | CO2 (HCl):用NaOH溶液洗气后干燥 | |
| D. | MnO2 (KCl):加水溶解后,过滤、洗涤、烘干 |
分析 A.Fe与硫酸铜反应生成硫酸亚铁和Cu;
B.二氧化碳与NaOH反应,而CO不能;
C.二者均与NaOH反应;
D.KCl溶于水,而MnO2不溶于水.
解答 解:A.Fe与硫酸铜反应生成硫酸亚铁和Cu,反应后过滤可除杂,故A正确;
B.二氧化碳与NaOH反应,而CO不能,则洗气可分离,故B正确;
C.二者均与NaOH反应,不能除杂,应选饱和碳酸氢钠溶液、洗气,故C错误;
D.KCl溶于水,而MnO2不溶于水,则溶解、过滤、洗涤、烘干可分离,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{M}{6.02×1{0}^{23}}$g | B. | $\frac{1}{M}$ g | C. | M g | D. | $\frac{6.02×1{0}^{23}}{M}$ g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液的强 | |
| B. | 氧化钠是强电解质,醋酸是弱电解质 | |
| C. | 氨气是弱电解质,铜是强电解质 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,电子从a极流向b极 | |
| D. | a极上发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
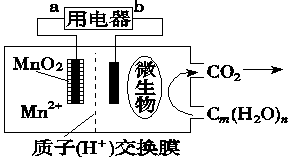
| A. | 电池工作时,电子由b流向a | |
| B. | 正极反应式为:MnO2+4H++2e-═Mn2++2H2O | |
| C. | 放电过程中,H+从负极区移向正极区 | |
| D. | 微生物所在电极区放电时发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(A-) | B. | c(Na+)<c(A-) | C. | c(Na+)>c(A-) | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlO2- | B. | Fe3+ | C. | HCO3- | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
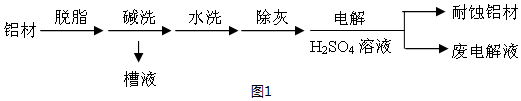
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:填空题
纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:

(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的Ca2+、Mg2+等沉淀,可以向其中加入过量纯碱.此时将混合液中不溶物除去的方法是_______,该操作中所用的仪器有铁架台(带铁圈)、烧杯等,还需要使用的仪器有___________,溶液中多余的纯碱可以加_________试剂来除去。
(2)上述工艺流程中,加压条件下通入二氧化碳进行碳酸化时没有析出碳酸钠晶体,其原因是_________。整个过程中循环利用的物质是________(用化学式表示)。
(3)若采用上述流程生产106吨纯碱,则理论上通入的二氧化碳的体积(标准状况下)不得少于_________L(不考虑二氧化碳的回收利用)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com