解:(1)由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl
3与H
2,
反应方程式为NH
4Cl+2HCl═3H
2↑+NCl
3.
故答案为:NH
4Cl+2HCl═3H
2↑+NCl
3.
(2)A、ClO
2易溶于水,不能利用碳酸钠溶液吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO
2,故C正确;
D、ClO
2易溶于水,不能利用水吸收氨气,故D错误.
故选:C.
(3)①由题目信息可知,ClO
2通入锥形瓶与酸性碘化钾溶液反应,氧化I
-为I
2,自身被还原为Cl
-,同时生成水,反应离子方程式为2ClO
2+10I
-+8H
+=2Cl
-+5I
2+4H
2O.
故答案为:2ClO
2+10I
-+8H
+=2Cl
-+5I
2+4H
2O.
②装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
故答案为:用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点.
故答案为:溶液由蓝色恰好变为无色,且半分钟内不褪色,.
④VmLNa
2S
2O
3溶液含有Na
2S
2O
3物质的量为V?10
-3 L×cmol/L=c?V?10
-3 mol.则:
根据关系式:2ClO
2~5I
2~10Na
2S
2O
3,
2 10
n(ClO
2) c?V?10
-3 mol
所以n(ClO
2)=

c?V?10
-3 mol.
所以m(ClO
2)=

c?V?10
-3 mol×67.5g/mol=1.35cv×10
-2g.
故答案为:1.35cv×10
-2g.
(4)①取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上灼烧,火焰呈黄色,说明溶液X中含有钠离子.
故答案为:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上灼烧;火焰呈黄色.
②取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液),产生白色沉淀,说明溶液X中含有氯离子.
故答案为:取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液);产生白色沉淀.
分析:(1)由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl
3与H
2.
(2)由信息可知,ClO
2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体.据此判断.
(3)①由题目信息可知,ClO
2通入锥形瓶与酸性碘化钾溶液反应,氧化I
-为I
2,自身被还原为Cl
-,同时生成水.
②用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③溶液由蓝色恰好变为无色,且半分钟内不褪色,说明滴定至终点.
④根据关系式2ClO
2~5I
2~10Na
2S
2O
3计算n(ClO
2),再根据m=nM计算m(ClO
2).
(4)若溶液X中含有钠离子,可以利用焰色反应检验Na
+.若溶液X中含有氯离子,利用氯化银白色沉淀检验Cl
-.
点评:考查阅读题目获取信息能力、氧化还原反应滴定及应用、离子检验、对工艺流程及装置理解分析等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.注意基础知识的全面掌握.



 c?V?10-3 mol.
c?V?10-3 mol. c?V?10-3 mol×67.5g/mol=1.35cv×10-2g.
c?V?10-3 mol×67.5g/mol=1.35cv×10-2g.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.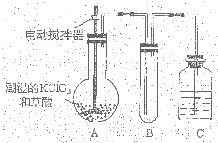 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题: