
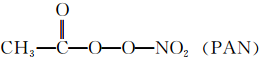 等二次污染物.
等二次污染物.分析 (1)As原子核外电子数为33,根据能量最低原理书写核外电子排布式;
(2)Fe3+含有空轨道,CN-含有孤对电子,二者之间形成配位键;原子数目相等、价电子数目相等的微粒互为等电子体;
(3)①N2O结构式可表示为N=N=O,N2O中中心氮原子形成2个σ键、没有孤对电子,杂化轨道数目为2;
单键为σ键,双键含有1个σ键、1个π键,PAN分子中σ键数目为10;
②Kr晶体为面心立方晶体,以定点Kr原子研究,与之相邻的Kr原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,利用均摊法计算晶胞中Kr原子数目、晶胞中Kr原子配位数;
结合晶胞中含有Kr原子数目,表示出晶胞质量,再结合m=ρV计算晶胞棱长.
解答 解:(1)As原子核外电子数为33,根据能量最低原理,核外电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)Fe3+含有空轨道,CN-含有孤对电子,二者之间形成配位键;原子数目相等、价电子数目相等的微粒互为等电子体,与CN-互为等电子体的化合物分子式为CO,
故答案为:配位;CO;
(3)①N2O结构式可表示为N=N=O,N2O中中心氮原子形成2个σ键、没有孤对电子,杂化轨道数目为2,N原子采取sp杂化;单键为σ键,双键含有1个σ键、1个π键,PAN分子中σ键数目为10,则l mol PAN中含σ键数目为10NA,
故答案为:sp;10NA;
②Kr晶体为面心立方晶体,以定点Kr原子研究,与之相邻的Kr原子处于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,晶体中与每个Kr原子相紧邻的Kr原子数为$\frac{3×8}{2}$=12,晶胞中Kr原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则$\frac{m}{n}$=3;
晶胞质量为4×$\frac{M}{{N}_{A}}$g,晶体的密度为ρg/cm3,则ρg/cm3×(a×10-7 cm)3=4×$\frac{M}{{N}_{A}}$g,解得a=$\root{3}{\frac{4M}{ρ{N}_{A}}}$×10-7,
故答案为:$\root{3}{\frac{4M}{ρ{N}_{A}}}$×10-7.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、等电子体、杂化方式、化学键、晶胞计算等,是都物质结构主干知识考查,(3)中计算为易错点,需要学生具备一定的空间想象,理解掌握用均摊法进行晶胞有关计算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 肯定不存在的离子是Fe3+、Cu2+、SO42-、CO32-、MnO4-,而是否含NH4+、另需实验验证 | |
| B. | 肯定存在的离子是SO32-、Br-,且Na+、K+离子至少有一种存在 | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
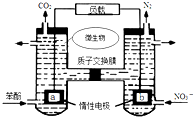
| A. | a电极发生还原反应 | |
| B. | H+由右室通过质子交换膜进入左室 | |
| C. | b电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 电池工作时,电流由a电极沿导线流向b电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次 | |
| B. | 用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种 | |
| C. | 利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果 | |
| D. | 若要测定所得硫酸铜晶体中结晶水的数目,在实验中要用到坩埚和坩埚钳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,OH-向负极方向移动 | |
| B. | 放电时,正极反应式为Zn+2OH--2e-═ZnO+H2O | |
| C. | 充电时,Zn发生氧化反应 | |
| D. | 充电时,阴极附近PH 减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
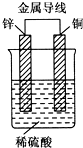 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
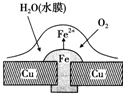
| A. | 正极的电极反应为:2H++2e-═H2↑ | |
| B. | 此过程中还涉及反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| C. | 此过程中铜并不被腐蚀 | |
| D. | 此过程中电子从Fe移向Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com